2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 地方特色艺术品承载着厚重历史文化。下列艺术品
主要含有无机非金属材料的是
A.涪城剪纸
B.雾山石刻
C.炳林毛笔
D.李白诗意绣
主要含有无机非金属材料的是
A.涪城剪纸
B.雾山石刻
C.炳林毛笔
D.李白诗意绣
答案:
1. B 常规考点化学与传统文化,涉及剪纸、石刻、毛笔、绣品等
[深度解析]纸的主要成分是纤维素,属于天然有机高分子材料,A不符合题意;雾山石刻所用岩石的主要成分是碳酸钙、二氧化硅等,属于无机非金属材料,B符合题意;毛笔的笔杆多为木材,主要成分为纤维素,笔头为动物毛发,主要成分为蛋白质,均属于有机高分子材料,C不符合题意;李白诗意绣是绣品,使用的材料是丝绸,其主要成分为蛋白质,属于有机高分子材料,D不符合题意。
[深度解析]纸的主要成分是纤维素,属于天然有机高分子材料,A不符合题意;雾山石刻所用岩石的主要成分是碳酸钙、二氧化硅等,属于无机非金属材料,B符合题意;毛笔的笔杆多为木材,主要成分为纤维素,笔头为动物毛发,主要成分为蛋白质,均属于有机高分子材料,C不符合题意;李白诗意绣是绣品,使用的材料是丝绸,其主要成分为蛋白质,属于有机高分子材料,D不符合题意。
2. 下列与物质性质相关的说法正确的是
A.金属铝具有还原性,可用于冶炼金属
B.聚丙烯是高分子材料,可用作吸水剂
C.煮番茄蛋汤时,加入大量的盐可以促进蛋白质的溶解
D.油脂难溶于水,其皂化反应产物的结构中不含亲水
基团
A.金属铝具有还原性,可用于冶炼金属
B.聚丙烯是高分子材料,可用作吸水剂
C.煮番茄蛋汤时,加入大量的盐可以促进蛋白质的溶解
D.油脂难溶于水,其皂化反应产物的结构中不含亲水
基团
答案:
2. A 常规考点,物质性质与用途,涉及金属冶炼、高分子材料性质、蛋白质盐析、皂化反应等
[深度解析]金属铝的还原性较强,可通过铝热反应冶炼金属Fe等,A正确;聚丙烯是高分子材料,但分子中不含亲水基团(如—OH、—COOH等),吸水性极差,不能用作吸水剂,B错误;蛋白质在盐的浓溶液中会发生“盐析”,煮番茄蛋汤时加入大量盐会导致蛋白质析出,而非促进溶解,C错误;油脂的皂化反应产物是高级脂肪酸盐和甘油,其中高级脂肪酸盐中含亲水基团(—COO⁻),甘油中含亲水基团(—OH),D错误。
知识拓展:亲水基团是指分子中易与水发生相互作用(如形成氢键)或溶于水的原子团,含有该基团的位置更易溶于水。常见的亲水基团有羟基(—OH)、羧基(—COOH)、氨基(—NH₂)、磺酸基(—SO₃H)、磷酸基(—PO₃H₂)等。
[深度解析]金属铝的还原性较强,可通过铝热反应冶炼金属Fe等,A正确;聚丙烯是高分子材料,但分子中不含亲水基团(如—OH、—COOH等),吸水性极差,不能用作吸水剂,B错误;蛋白质在盐的浓溶液中会发生“盐析”,煮番茄蛋汤时加入大量盐会导致蛋白质析出,而非促进溶解,C错误;油脂的皂化反应产物是高级脂肪酸盐和甘油,其中高级脂肪酸盐中含亲水基团(—COO⁻),甘油中含亲水基团(—OH),D错误。
知识拓展:亲水基团是指分子中易与水发生相互作用(如形成氢键)或溶于水的原子团,含有该基团的位置更易溶于水。常见的亲水基团有羟基(—OH)、羧基(—COOH)、氨基(—NH₂)、磺酸基(—SO₃H)、磷酸基(—PO₃H₂)等。
3. 下列化学用语或图示正确的是
A.HClO 的电子式:H⁺[:O:Cl:]⁻
B.丙酸的分子式:CH₃CH₂COOH
C.CO₂ 的 π 键电子云轮廓图:
D.基态 Ca²⁺ 的最外层电子排布图: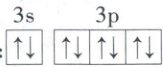
A.HClO 的电子式:H⁺[:O:Cl:]⁻
B.丙酸的分子式:CH₃CH₂COOH
C.CO₂ 的 π 键电子云轮廓图:

D.基态 Ca²⁺ 的最外层电子排布图:

答案:
3. D 常规考点,化学用语,涉及电子式、分子式、电子云轮廓图、核外电子排布等
[深度解析]HClO的结构式为H—O—Cl,属于共价化合物,电子式为H:Ö:Cl:,A错误;丙酸的分子式是C₃H₆O₂,CH₃CH₂COOH是丙酸的结构简式,B错误;π键是由两个原子的p轨道通过“肩并肩”方式形成,电子云轮廓图应为镜面对称,如图: ,C错误;基态Ca²⁺的核外电子排布式为1s²2s²2p⁶3s²3p⁶,最外层电子排布式为3s²3p⁶,对应电子排布图为
,C错误;基态Ca²⁺的核外电子排布式为1s²2s²2p⁶3s²3p⁶,最外层电子排布式为3s²3p⁶,对应电子排布图为 ,D正确。
,D正确。
3. D 常规考点,化学用语,涉及电子式、分子式、电子云轮廓图、核外电子排布等
[深度解析]HClO的结构式为H—O—Cl,属于共价化合物,电子式为H:Ö:Cl:,A错误;丙酸的分子式是C₃H₆O₂,CH₃CH₂COOH是丙酸的结构简式,B错误;π键是由两个原子的p轨道通过“肩并肩”方式形成,电子云轮廓图应为镜面对称,如图:
 ,C错误;基态Ca²⁺的核外电子排布式为1s²2s²2p⁶3s²3p⁶,最外层电子排布式为3s²3p⁶,对应电子排布图为
,C错误;基态Ca²⁺的核外电子排布式为1s²2s²2p⁶3s²3p⁶,最外层电子排布式为3s²3p⁶,对应电子排布图为 ,D正确。
,D正确。 4. 硝苯地平常用于治疗高血压和心绞痛。合成硝苯地
平的中间体 M 的结构简式如图,下列关于 M 的说法
错误的是
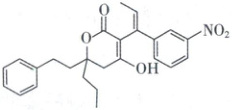
A.分子式为 C₂₅H₂₇O₅N
B.sp³ 杂化的碳原子数目为 6
C.分子中有 1 个手性碳原子
D.能发生氧化反应和加成反应
平的中间体 M 的结构简式如图,下列关于 M 的说法
错误的是

A.分子式为 C₂₅H₂₇O₅N
B.sp³ 杂化的碳原子数目为 6
C.分子中有 1 个手性碳原子
D.能发生氧化反应和加成反应
答案:
4. B 常规考点有机物的结构与性质,涉及分子式、碳原子杂化类型、手性碳、反应类型等
[深度解析]由该有机物的结构简式可知,其分子式为C₂₅H₂₇O₅N,A正确;sp³杂化碳原子需满足“形成4个σ键”,即为饱和碳原子,由结构简式可知该有机物分子中含8个sp³杂化的碳原子,B错误;手性碳原子是连有4个不同原子或基团的饱和碳原子,故该分子中含有1个手性C原子,如图 ,C正确;分子中含苯环、碳碳双键,可发生加成反应,含碳碳双键,且与苯环直接相连的C上有H,可发生氧化反应,D正确。
,C正确;分子中含苯环、碳碳双键,可发生加成反应,含碳碳双键,且与苯环直接相连的C上有H,可发生氧化反应,D正确。
4. B 常规考点有机物的结构与性质,涉及分子式、碳原子杂化类型、手性碳、反应类型等
[深度解析]由该有机物的结构简式可知,其分子式为C₂₅H₂₇O₅N,A正确;sp³杂化碳原子需满足“形成4个σ键”,即为饱和碳原子,由结构简式可知该有机物分子中含8个sp³杂化的碳原子,B错误;手性碳原子是连有4个不同原子或基团的饱和碳原子,故该分子中含有1个手性C原子,如图
 ,C正确;分子中含苯环、碳碳双键,可发生加成反应,含碳碳双键,且与苯环直接相连的C上有H,可发生氧化反应,D正确。
,C正确;分子中含苯环、碳碳双键,可发生加成反应,含碳碳双键,且与苯环直接相连的C上有H,可发生氧化反应,D正确。 5. 下列实验装置能达到相应实验目的的是
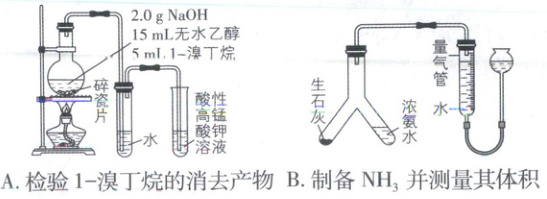
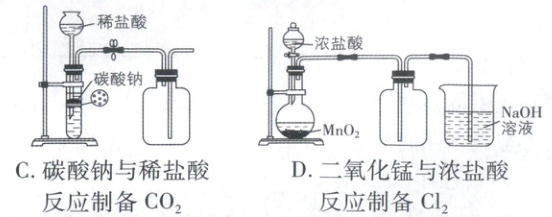


答案:
5. A 经典题型,实验方案的设计与评价,涉及气体的制备、检验、收集、除杂等
[深度解析]1 - 溴丁烷在NaOH醇溶液、加热条件下发生消去反应生成1 - 丁烯,用水除去挥发出的乙醇,通过观察酸性KMnO₄溶液是否褪色可检验消去产物,装置合理,A正确;NH₃极易溶于水,不能用排水法测量体积,B错误;碳酸钠是易溶于水的粉末状固体,不适合用该装置,且CO₂密度大于空气,应使用向上排空气法收集,C错误;MnO₂与浓盐酸反应制备Cl₂需要加热条件,D错误。
[深度解析]1 - 溴丁烷在NaOH醇溶液、加热条件下发生消去反应生成1 - 丁烯,用水除去挥发出的乙醇,通过观察酸性KMnO₄溶液是否褪色可检验消去产物,装置合理,A正确;NH₃极易溶于水,不能用排水法测量体积,B错误;碳酸钠是易溶于水的粉末状固体,不适合用该装置,且CO₂密度大于空气,应使用向上排空气法收集,C错误;MnO₂与浓盐酸反应制备Cl₂需要加热条件,D错误。
6. 单斜硫和正交硫的分子式都为 S₈,但晶体结构和物理
性质不同。实验测定某药用硫黄中硫的含量涉及反
应:S+3H₂O₂+2NaOH ══ Na₂SO₄+4H₂O。下列说法
错误的是
A.单斜硫和正交硫是硫的两种同素异形体
B.H₂O₂ 是非极性分子,含有极性键和非极性键
C.NaOH 和 H₂O 晶体分别为离子晶体和分子晶体
D.SO₄²⁻ 的 VSEPR 模型和空间结构都为正四面体形
性质不同。实验测定某药用硫黄中硫的含量涉及反
应:S+3H₂O₂+2NaOH ══ Na₂SO₄+4H₂O。下列说法
错误的是
A.单斜硫和正交硫是硫的两种同素异形体
B.H₂O₂ 是非极性分子,含有极性键和非极性键
C.NaOH 和 H₂O 晶体分别为离子晶体和分子晶体
D.SO₄²⁻ 的 VSEPR 模型和空间结构都为正四面体形
答案:
6. B 常规考点物质结构与分类,涉及同素异形体、分子极性、晶体类型、VSEPR模型与空间结构等
[深度解析]单斜硫和正交硫均是由S元素组成的不同单质,互为同素异形体,A正确;H₂O₂中O原子采用sp³杂化,4个原子不在一条直线上,结构为H—O—O—H,正、负电中心不重合,属于极性分子,B错误;NaOH晶体由Na⁺与OH⁻通过离子键结合,属于离子晶体,H₂O晶体通过分子间作用力结合,属于分子晶体,C正确;SO₄²⁻中S原子连有4个O原子,无孤电子对,则价层电子对数为4,VSEPR模型为正四面体形,空间结构也为正四面体形,D正确。
[深度解析]单斜硫和正交硫均是由S元素组成的不同单质,互为同素异形体,A正确;H₂O₂中O原子采用sp³杂化,4个原子不在一条直线上,结构为H—O—O—H,正、负电中心不重合,属于极性分子,B错误;NaOH晶体由Na⁺与OH⁻通过离子键结合,属于离子晶体,H₂O晶体通过分子间作用力结合,属于分子晶体,C正确;SO₄²⁻中S原子连有4个O原子,无孤电子对,则价层电子对数为4,VSEPR模型为正四面体形,空间结构也为正四面体形,D正确。
7. 解释下列实验现象的离子方程式正确的是
A.银氨溶液中滴加 Na₂S,产生灰黑色沉淀:
2Ag⁺+S²⁻══Ag₂S↓
B.NaHSO₄ 溶液中滴加少量 Ba(OH)₂,析出沉淀:
H⁺+SO₄²⁻+Ba²⁺+OH⁻══BaSO₄↓+H₂O
C.K₃[Fe(CN)₆] 溶液中滴加 FeCl₂,产生蓝色沉淀:
K⁺+Fe²⁺+[Fe(CN)₆]³⁻══KFe[Fe(CN)₆]↓
D.二元弱酸 H₃PO₃ 的溶液中滴加足量烧碱溶液,反
应放热:H₃PO₃+3OH⁻══PO₃³⁻+3H₂O
A.银氨溶液中滴加 Na₂S,产生灰黑色沉淀:
2Ag⁺+S²⁻══Ag₂S↓
B.NaHSO₄ 溶液中滴加少量 Ba(OH)₂,析出沉淀:
H⁺+SO₄²⁻+Ba²⁺+OH⁻══BaSO₄↓+H₂O
C.K₃[Fe(CN)₆] 溶液中滴加 FeCl₂,产生蓝色沉淀:
K⁺+Fe²⁺+[Fe(CN)₆]³⁻══KFe[Fe(CN)₆]↓
D.二元弱酸 H₃PO₃ 的溶液中滴加足量烧碱溶液,反
应放热:H₃PO₃+3OH⁻══PO₃³⁻+3H₂O
答案:
7. C 经典题型离子方程式正误判断,涉及配合物、量的影响等
[深度解析]银氨溶液中,Ag(I)存在形式是[Ag(NH₃)₂]⁺而非Ag⁺,反应的离子方程式为2[Ag(NH₃)₂]⁺+S²⁻ = Ag₂S↓+4NH₃,A错误;NaHSO₄溶液中滴加少量Ba(OH)₂,Ba(OH)₂完全反应,n(Ba²⁺):n(OH⁻)=1:2,离子方程式为2H⁺+SO₄²⁻+Ba²⁺+2OH⁻ = BaSO₄↓+2H₂O,B错误;K₃[Fe(CN)₆]与FeCl₂反应生成蓝色沉淀KFe[Fe(CN)₆],所给离子方程式符合电荷、原子守恒,C正确;H₃PO₃是二元弱酸,与足量NaOH溶液反应生成Na₂HPO₃溶液,离子方程式为H₃PO₃+2OH⁻ = HPO₃²⁻+2H₂O,D错误。
[深度解析]银氨溶液中,Ag(I)存在形式是[Ag(NH₃)₂]⁺而非Ag⁺,反应的离子方程式为2[Ag(NH₃)₂]⁺+S²⁻ = Ag₂S↓+4NH₃,A错误;NaHSO₄溶液中滴加少量Ba(OH)₂,Ba(OH)₂完全反应,n(Ba²⁺):n(OH⁻)=1:2,离子方程式为2H⁺+SO₄²⁻+Ba²⁺+2OH⁻ = BaSO₄↓+2H₂O,B错误;K₃[Fe(CN)₆]与FeCl₂反应生成蓝色沉淀KFe[Fe(CN)₆],所给离子方程式符合电荷、原子守恒,C正确;H₃PO₃是二元弱酸,与足量NaOH溶液反应生成Na₂HPO₃溶液,离子方程式为H₃PO₃+2OH⁻ = HPO₃²⁻+2H₂O,D错误。
8. X、Y、Z、W、Q 为原子序数依次增大的短周期元素,X、
Q 同族,Y、Z、W 同周期。将 ZW₂ 气体通入 QXYW₃,
溶液可发生反应:3ZW₂ +2QXYW₃ ══ 2QZW₃ +ZW +
2YW₂ +X₂W。下列说法正确的是
A.电负性:Y>W
B.第一电离能:Z>W
C.简单离子半径:Q>W
D.简单气态氢化物的稳定性:Y>W
Q 同族,Y、Z、W 同周期。将 ZW₂ 气体通入 QXYW₃,
溶液可发生反应:3ZW₂ +2QXYW₃ ══ 2QZW₃ +ZW +
2YW₂ +X₂W。下列说法正确的是
A.电负性:Y>W
B.第一电离能:Z>W
C.简单离子半径:Q>W
D.简单气态氢化物的稳定性:Y>W
答案:
8. B 经典题型元素推断与元素周期律,涉及电负性、第一电离能、离子半径、氢化物稳定性等
元素梳理:X、Y、Z、W、Q为原子序数依次增大的短周期元素,X、Q同族,Y、Z、W同周期,则X位于第一周期,为H元素,Q位于第三周期,为Na元素;第二周期元素W与H形成H₂W,则W为O元素;QXYW₃为NaHCO₃,则Y为C元素;Z位于Y和W之间,则Z为N元素。综上:X为H,Y为C,Z为N,W为O,Q为Na。
[深度解析]同周期主族元素从左到右电负性增大,故电负性:O > C,即W > Y,A错误;同周期主族元素从左到右第一电离能呈增大趋势,因N原子的2p轨道为半充满的稳定结构,第一电离能大于同周期的相邻元素,故第一电离能:N > O,即Z > W,B正确;Na⁺和O²⁻电子层结构相同,核电荷数越大半径越小,故简单离子半径:O²⁻ > Na⁺,即W > Q,C错误;非金属性越强,其简单气态氢化物越稳定,非金属性:O > C,则简单气态氢化物稳定性:O > C,即W > Y,D错误。
元素梳理:X、Y、Z、W、Q为原子序数依次增大的短周期元素,X、Q同族,Y、Z、W同周期,则X位于第一周期,为H元素,Q位于第三周期,为Na元素;第二周期元素W与H形成H₂W,则W为O元素;QXYW₃为NaHCO₃,则Y为C元素;Z位于Y和W之间,则Z为N元素。综上:X为H,Y为C,Z为N,W为O,Q为Na。
[深度解析]同周期主族元素从左到右电负性增大,故电负性:O > C,即W > Y,A错误;同周期主族元素从左到右第一电离能呈增大趋势,因N原子的2p轨道为半充满的稳定结构,第一电离能大于同周期的相邻元素,故第一电离能:N > O,即Z > W,B正确;Na⁺和O²⁻电子层结构相同,核电荷数越大半径越小,故简单离子半径:O²⁻ > Na⁺,即W > Q,C错误;非金属性越强,其简单气态氢化物越稳定,非金属性:O > C,则简单气态氢化物稳定性:O > C,即W > Y,D错误。
9. 制备光伏组件封装胶膜的基础树脂 N 的合成方法如
下(无机产物省略):
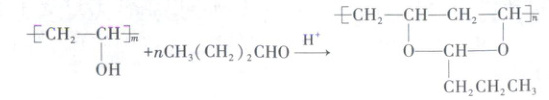
下列说法正确的是
A.n = 2m
B.该反应属于加聚反应
C.该反应的无机产物为 H₂O
D.N 在碱性条件下能水解
下(无机产物省略):

下列说法正确的是
A.n = 2m
B.该反应属于加聚反应
C.该反应的无机产物为 H₂O
D.N 在碱性条件下能水解
答案:
9. C 常规考点有机高分子的合成与性质,涉及聚合度、有机反应类型、产物判断等
[深度解析]反应为羟基(—OH)与醛基(—CHO)的缩合反应,生成醚键(—O—)和水,根据合成方法可知,2个—OH与1个—CHO反应,故m与n的关系应为m = 2n,A错误,C正确;加聚反应无小分子生成,而该反应生成H₂O,属于缩合反应,B错误;基础树脂N的结构中含有的官能团只有醚键(—O—),醚键在碱性条件下不水解,D错误。
快解:根据原子守恒可快速判断“加聚反应”与“缩聚反应”:加聚→只有高分子产物;缩聚→除了高分子外还有小分子(如H₂O、HCl等)产生。
[深度解析]反应为羟基(—OH)与醛基(—CHO)的缩合反应,生成醚键(—O—)和水,根据合成方法可知,2个—OH与1个—CHO反应,故m与n的关系应为m = 2n,A错误,C正确;加聚反应无小分子生成,而该反应生成H₂O,属于缩合反应,B错误;基础树脂N的结构中含有的官能团只有醚键(—O—),醚键在碱性条件下不水解,D错误。
快解:根据原子守恒可快速判断“加聚反应”与“缩聚反应”:加聚→只有高分子产物;缩聚→除了高分子外还有小分子(如H₂O、HCl等)产生。
查看更多完整答案,请扫码查看


