2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (11分)从富贵锑废料(含${AgCl}$、${PbCl_{2}}$、${Sb_{2}O_{5}}$、${SiO_{2}}$
等)中提取${Ag}$的新工艺如下:
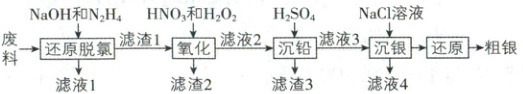
回答下列问题:
(1)“还原脱氯”中为了提高反应速率,可以采取的
措施为
绿色还原剂,该操作单元将废料中${AgCl}$转化为${Ag}$的化学方程式为
(2)“氧化”时,新工艺是在${HNO_{3}}$的基础上增加了
${H_{2}O_{2}}$,增加${H_{2}O_{2}}$的目的为
(3)“沉铅”时,需控制硫酸的用量,目的为
。
(4)“沉银”时,为保证${Ag^{+}}$沉淀完全且不溶解,需控
制${Cl^{-}}$浓度范围为
完全指离子浓度小于$1.0× 10^{-5}\ {mol· L^{-1}}$,不溶解指
产物浓度小于$1.0× 10^{-5}\ {mol· L^{-1}}$)。
(5)通过电解精炼提高粗银纯度时,精银需连接直流
电源的
(6)从废料中提取${Ag}$的另一种方法是先将${AgCl}$转
化为${[Ag(SO_{3})_{2}]^{3-}}$,再还原为${Ag}$。写出少量${HCHO}$
在碱性条件下还原${[Ag(SO_{3})_{2}]^{3-}}$的离子方程式:
等)中提取${Ag}$的新工艺如下:

回答下列问题:
(1)“还原脱氯”中为了提高反应速率,可以采取的
措施为
适当提高反应温度(答案合理即可,1分)
(填一种即可)。${N_{2}H_{4}}$是绿色还原剂,该操作单元将废料中${AgCl}$转化为${Ag}$的化学方程式为
4AgCl + N₂H₄ + 4NaOH = 4Ag + N₂↑ + 4NaCl + 4H₂O
。(2)“氧化”时,新工艺是在${HNO_{3}}$的基础上增加了
${H_{2}O_{2}}$,增加${H_{2}O_{2}}$的目的为
减少硝酸用量,避免产生氮氧化物污染环境
。(3)“沉铅”时,需控制硫酸的用量,目的为
防止硫酸过量时生成Ag₂SO₄沉淀
。
(4)“沉银”时,为保证${Ag^{+}}$沉淀完全且不溶解,需控
制${Cl^{-}}$浓度范围为
1.8×10⁻⁵~0.5
${mol· L^{-1}}$(沉淀完全指离子浓度小于$1.0× 10^{-5}\ {mol· L^{-1}}$,不溶解指
产物浓度小于$1.0× 10^{-5}\ {mol· L^{-1}}$)。
(5)通过电解精炼提高粗银纯度时,精银需连接直流
电源的
负
极(填“正”或“负”)。(6)从废料中提取${Ag}$的另一种方法是先将${AgCl}$转
化为${[Ag(SO_{3})_{2}]^{3-}}$,再还原为${Ag}$。写出少量${HCHO}$
在碱性条件下还原${[Ag(SO_{3})_{2}]^{3-}}$的离子方程式:
4[Ag(SO₃)₂]³⁻ + HCHO + 6OH⁻ = 4Ag↓ + 8SO₃²⁻ + CO₃²⁻ + 4H₂O
。
答案:
17.(除标注外,每空2分,共11分)
(1)适当提高反应温度(答案合理即可,1分) 4AgCl + N₂H₄ + 4NaOH = 4Ag + N₂↑ + 4NaCl + 4H₂O
(2)减少硝酸用量,避免产生氮氧化物污染环境
(3)防止硫酸过量时生成Ag₂SO₄沉淀(1分)
(4)1.8×10⁻⁵~0.5
(5)负(1分)
(6)4[Ag(SO₃)₂]³⁻ + HCHO + 6OH⁻ = 4Ag↓ + 8SO₃²⁻ + CO₃²⁻ + 4H₂O
(1)适当提高反应温度(答案合理即可,1分) 4AgCl + N₂H₄ + 4NaOH = 4Ag + N₂↑ + 4NaCl + 4H₂O
(2)减少硝酸用量,避免产生氮氧化物污染环境
(3)防止硫酸过量时生成Ag₂SO₄沉淀(1分)
(4)1.8×10⁻⁵~0.5
(5)负(1分)
(6)4[Ag(SO₃)₂]³⁻ + HCHO + 6OH⁻ = 4Ag↓ + 8SO₃²⁻ + CO₃²⁻ + 4H₂O
18. (13分)为探究工业品硫的性质并测定其纯度设计
了如下实验(忽略杂质的反应)。
Ⅰ. 性质探究:
Ⅱ. 纯度测定:
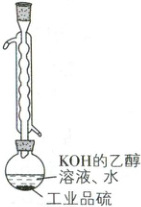
①取少量工业品硫研成粉末,准确称
取$m\ {g}$置于圆底烧瓶中,装置如图
(加热、夹持、搅拌装置已略去),准
确加入$V_{1}\ {mL}\ {KOH}$的乙醇溶液(过
量),加入蒸馏水,搅拌,$85\ ^{\circ}C$回流至
样品完全溶解后,蒸馏除去乙醇。
②冷却后,向圆底烧瓶中加入适量蒸馏水,搅拌下缓
慢滴加足量$30\%\ {H_{2}O_{2}}$,加热至$100\ ^{\circ}C$,保持$20\ {min}$,
冷却至室温。
③将圆底烧瓶中溶液全部转移至锥形瓶中,加入2
滴甲基橙,用$c\ {mol· L^{-1}}\ {HCl}$标准溶液滴定至终点,
平行实验多次,记录实验数据。
④不加工业品硫,重复步骤①②③做空白实验,平行
实验多次,记录实验数据。
回答下列问题:
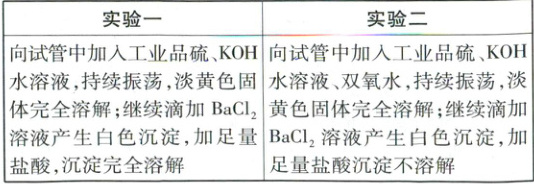
(1)“实验一”试管中淡黄色固体溶解后,溶液中的
含硫物质为${K_{2}SO_{3}}$和
二”中淡黄色固体溶解的化学方程式为
(2)球形冷凝管的作用是
向圆底烧瓶中准确加入$V_{1}\ {mL}\ {KOH}$的乙醇溶液时,
可选用的仪器为
A. $50\ {mL}$量筒
B. 移液管
C. 酸式滴定管
(3)乙醇的作用是
必须蒸馏除去乙醇的原因是
步骤①加热回流时可选用的热源为
A. 水浴
B. 酒精灯
C. 电热套
(4)实验数据如下:
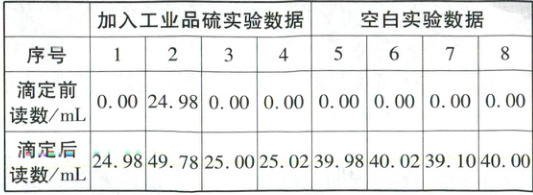
应舍弃的数据为
的纯度为
了如下实验(忽略杂质的反应)。
Ⅰ. 性质探究:


Ⅱ. 纯度测定:
①取少量工业品硫研成粉末,准确称
取$m\ {g}$置于圆底烧瓶中,装置如图
(加热、夹持、搅拌装置已略去),准
确加入$V_{1}\ {mL}\ {KOH}$的乙醇溶液(过
量),加入蒸馏水,搅拌,$85\ ^{\circ}C$回流至
样品完全溶解后,蒸馏除去乙醇。
②冷却后,向圆底烧瓶中加入适量蒸馏水,搅拌下缓
慢滴加足量$30\%\ {H_{2}O_{2}}$,加热至$100\ ^{\circ}C$,保持$20\ {min}$,
冷却至室温。
③将圆底烧瓶中溶液全部转移至锥形瓶中,加入2
滴甲基橙,用$c\ {mol· L^{-1}}\ {HCl}$标准溶液滴定至终点,
平行实验多次,记录实验数据。
④不加工业品硫,重复步骤①②③做空白实验,平行
实验多次,记录实验数据。
回答下列问题:
(1)“实验一”试管中淡黄色固体溶解后,溶液中的
含硫物质为${K_{2}SO_{3}}$和
K₂S
(填化学式)。“实验二”中淡黄色固体溶解的化学方程式为
S + 2KOH + 3H₂O₂ = K₂SO₄ + 4H₂O
。(2)球形冷凝管的作用是
冷凝回流乙醇
。向圆底烧瓶中准确加入$V_{1}\ {mL}\ {KOH}$的乙醇溶液时,
可选用的仪器为
B
(填序号)。A. $50\ {mL}$量筒
B. 移液管
C. 酸式滴定管
(3)乙醇的作用是
促进单质硫的溶解
,样品完全溶解后,必须蒸馏除去乙醇的原因是
防止H₂O₂氧化乙醇,影响实验测定结果
。步骤①加热回流时可选用的热源为
AC
(填序号)。A. 水浴
B. 酒精灯
C. 电热套
(4)实验数据如下:

应舍弃的数据为
2、7
(填序号),测得工业品硫的纯度为
$\frac{24c}{m}$%
(写出计算式)。
答案:
18.(除标注外,每空1分,共13分)
(1)K₂S + 2KOH + 3H₂O₂ = K₂SO₄ + 4H₂O(2分)
(2)冷凝回流乙醇 B
(3)促进单质硫的溶解 防止H₂O₂氧化乙醇,影响实验测定结果 AC(2分)
(4)2、7(2分) $\frac{24c}{m}$%(2分)
(1)K₂S + 2KOH + 3H₂O₂ = K₂SO₄ + 4H₂O(2分)
(2)冷凝回流乙醇 B
(3)促进单质硫的溶解 防止H₂O₂氧化乙醇,影响实验测定结果 AC(2分)
(4)2、7(2分) $\frac{24c}{m}$%(2分)
查看更多完整答案,请扫码查看


