2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (14 分)“分铜液净化渣”主要含有 $\mathrm{Cu}$、$\mathrm{Te}$、$\mathrm{Sb}$、$\mathrm{As}$ 等元素,回收工艺流程如图所示:
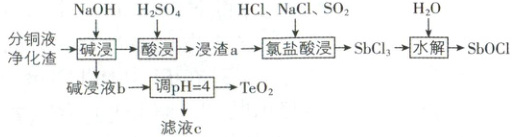
已知:①“碱浸”时,$\mathrm{Cu}$、$\mathrm{Sb}$ 转化为难溶物,碱浸液 $\mathrm{b}$ 中含有 $\mathrm{Na}_2\mathrm{TeO}_3$、$\mathrm{Na}_3\mathrm{AsO}_4$。
②“酸浸”时,浸渣中所含 $\mathrm{Sb}$ 元素生成难溶 $\mathrm{Sb}_2\mathrm{O}(\mathrm{SO}_4)_2$;$\mathrm{SbCl}_3$ 极易水解。
③常温下,$\mathrm{H}_3\mathrm{AsO}_4$ 的各级电离常数为 $K_\mathrm{a1} = 6.3 × 10^{-3}$、$K_\mathrm{a2} = 1.0 × 10^{-7}$、$K_\mathrm{a3} = 3.2 × 10^{-12}$。
(1)基态 $\mathrm{Cu}$ 原子的价层电子排布式为
(2)$\mathrm{Sb}_2\mathrm{O}(\mathrm{SO}_4)_2$ 中,$\mathrm{Sb}$ 的化合价为
(3)写出“水解”的化学方程式:
(4)写出“调 $\mathrm{pH} = 4$”时生成 $\mathrm{TeO}_2$ 的离子方程式:
(5)滤液 $\mathrm{c}$ 中 $\mathrm{As}$ 元素主要的存在形式为

已知:①“碱浸”时,$\mathrm{Cu}$、$\mathrm{Sb}$ 转化为难溶物,碱浸液 $\mathrm{b}$ 中含有 $\mathrm{Na}_2\mathrm{TeO}_3$、$\mathrm{Na}_3\mathrm{AsO}_4$。
②“酸浸”时,浸渣中所含 $\mathrm{Sb}$ 元素生成难溶 $\mathrm{Sb}_2\mathrm{O}(\mathrm{SO}_4)_2$;$\mathrm{SbCl}_3$ 极易水解。
③常温下,$\mathrm{H}_3\mathrm{AsO}_4$ 的各级电离常数为 $K_\mathrm{a1} = 6.3 × 10^{-3}$、$K_\mathrm{a2} = 1.0 × 10^{-7}$、$K_\mathrm{a3} = 3.2 × 10^{-12}$。
(1)基态 $\mathrm{Cu}$ 原子的价层电子排布式为
3d¹⁰4s¹
。(2)$\mathrm{Sb}_2\mathrm{O}(\mathrm{SO}_4)_2$ 中,$\mathrm{Sb}$ 的化合价为
+5(1分)
,通入 $\mathrm{SO}_2$ 的目的是作还原剂(1分)
,加入 $\mathrm{HCl}$ 的目的是抑制Sb³⁺的水解
。(3)写出“水解”的化学方程式:
SbCl₅ + H₂O = SbOCl↓ + 2HCl
,得到的产品中可能会含有Sb₂O₃
(填化学式)杂质。(4)写出“调 $\mathrm{pH} = 4$”时生成 $\mathrm{TeO}_2$ 的离子方程式:
TeO₃²⁻ + 2H⁺ = TeO₂↓ + H₂O
。(5)滤液 $\mathrm{c}$ 中 $\mathrm{As}$ 元素主要的存在形式为
H₂AsO₄⁻
(填微粒化学式)。
答案:
(除标注外,每空2分,共14分)
(1)3d¹⁰4s¹
(2)+5(1分) 作还原剂(1分) 抑制Sb³⁺的水解
(3)SbCl₅ + H₂O = SbOCl↓ + 2HCl Sb₂O₃
(4)TeO₃²⁻ + 2H⁺ = TeO₂↓ + H₂O
(5)H₂AsO₄⁻
必考题型 工艺流程题,涉及价层电子排布、化合价、实验操作的目的、离子方程式的书写、成分分析等
流程分析
原料:分铜液净化渣(主要含有Cu、Te、Sb、As等元素)
目标产物:SbOCl、TeO₂
除杂元素:Cu、As
碱浸:由已知①可知加入NaOH溶液“碱浸”后,Cu、Sb转化为难溶物进入“酸浸”步骤中,碱浸液b中含有Na₂TeO₃、Na₃AsO₄;
酸浸:结合已知②,“酸浸”时浸渣中的含Sb沉淀与H₂SO₄反应,生成难溶的Sb₂O(SO₄)₄进入浸渣a,Cu元素转化为可溶性铜盐经过滤除去;
调pH = 4:向碱浸液b中加入酸调节pH = 4,获得TeO₂,As元素进入滤液c;
氯盐酸浸:向浸渣a中加入HCl、NaCl、SO₂,将Sb₂O(SO₄)₄转化为SbCl₃;
水解:SbCl₃水解获得SbOCl。
[深度解析]
(1)Cu原子序数为29,故其基态原子的价层电子排布式为3d¹⁰4s¹。
(2)根据化合物中各元素正、负化合价代数和为0,Sb₂O(SO₄)₄中O为 -2价,S为 +6价,则Sb为 +5价;“氯盐酸浸”时,Sb元素由 +5价降低为 +3价,被还原,则通入SO₂作还原剂;根据已知②可知SbCl₃极易水解,其水解后会产生HCl,故加入HCl可抑制其水解。
(3)根据流程可知SbCl₃水解生成SbOCl,根据原子守恒可得化学方程式为3SbCl₃ + H₂O = SbOCl↓ + 2HCl;根据该反应可推测SbOCl还可能进一步水解:2SbOCl + H₂O = Sb₂O₃ + 2HCl,故可能得到的杂质是Sb₂O₃。
(4)根据流程和已知①可知,调节pH = 4时,Na₂TeO₃转化为TeO₂,结合电荷守恒和原子守恒可得离子方程式为TeO₃²⁻ + 2H⁺ = TeO₂↓ + H₂O。
(5)pH = 4时,Kₐ₁ = $\frac{c(H⁺)·c(H₂AsO₄⁻)}{c(H₃AsO₄)}$ = $\frac{10⁻⁴×c(H₂AsO₄⁻)}{c(H₃AsO₄)}$ = 6.3×10⁻³,Kₐ₂ = $\frac{c(H⁺)·c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = $\frac{10⁻⁴×c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = 1.0×10⁻⁷,故$\frac{c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = $\frac{1.0×10⁻⁷}{6.3×10⁻³}$ = 1.0×10⁻³,故滤液c中As元素主要的存在形式为H₂AsO₄⁻。
知识拓展 Sb₂O₃可用作白色颜料和阻燃剂等。在实验室中可利用SbCl₃的水解反应制取Sb₂O₃(SbCl₃的水解分三步进行,中间产物有SbOCl等),其总反应可表示为2SbCl₃ + 3H₂O$\rightleftharpoons$Sb₂O₃ + 6HCl。
(1)3d¹⁰4s¹
(2)+5(1分) 作还原剂(1分) 抑制Sb³⁺的水解
(3)SbCl₅ + H₂O = SbOCl↓ + 2HCl Sb₂O₃
(4)TeO₃²⁻ + 2H⁺ = TeO₂↓ + H₂O
(5)H₂AsO₄⁻
必考题型 工艺流程题,涉及价层电子排布、化合价、实验操作的目的、离子方程式的书写、成分分析等
流程分析
原料:分铜液净化渣(主要含有Cu、Te、Sb、As等元素)
目标产物:SbOCl、TeO₂
除杂元素:Cu、As
碱浸:由已知①可知加入NaOH溶液“碱浸”后,Cu、Sb转化为难溶物进入“酸浸”步骤中,碱浸液b中含有Na₂TeO₃、Na₃AsO₄;
酸浸:结合已知②,“酸浸”时浸渣中的含Sb沉淀与H₂SO₄反应,生成难溶的Sb₂O(SO₄)₄进入浸渣a,Cu元素转化为可溶性铜盐经过滤除去;
调pH = 4:向碱浸液b中加入酸调节pH = 4,获得TeO₂,As元素进入滤液c;
氯盐酸浸:向浸渣a中加入HCl、NaCl、SO₂,将Sb₂O(SO₄)₄转化为SbCl₃;
水解:SbCl₃水解获得SbOCl。
[深度解析]
(1)Cu原子序数为29,故其基态原子的价层电子排布式为3d¹⁰4s¹。
(2)根据化合物中各元素正、负化合价代数和为0,Sb₂O(SO₄)₄中O为 -2价,S为 +6价,则Sb为 +5价;“氯盐酸浸”时,Sb元素由 +5价降低为 +3价,被还原,则通入SO₂作还原剂;根据已知②可知SbCl₃极易水解,其水解后会产生HCl,故加入HCl可抑制其水解。
(3)根据流程可知SbCl₃水解生成SbOCl,根据原子守恒可得化学方程式为3SbCl₃ + H₂O = SbOCl↓ + 2HCl;根据该反应可推测SbOCl还可能进一步水解:2SbOCl + H₂O = Sb₂O₃ + 2HCl,故可能得到的杂质是Sb₂O₃。
(4)根据流程和已知①可知,调节pH = 4时,Na₂TeO₃转化为TeO₂,结合电荷守恒和原子守恒可得离子方程式为TeO₃²⁻ + 2H⁺ = TeO₂↓ + H₂O。
(5)pH = 4时,Kₐ₁ = $\frac{c(H⁺)·c(H₂AsO₄⁻)}{c(H₃AsO₄)}$ = $\frac{10⁻⁴×c(H₂AsO₄⁻)}{c(H₃AsO₄)}$ = 6.3×10⁻³,Kₐ₂ = $\frac{c(H⁺)·c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = $\frac{10⁻⁴×c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = 1.0×10⁻⁷,故$\frac{c(HAsO₄²⁻)}{c(H₂AsO₄⁻)}$ = $\frac{1.0×10⁻⁷}{6.3×10⁻³}$ = 1.0×10⁻³,故滤液c中As元素主要的存在形式为H₂AsO₄⁻。
知识拓展 Sb₂O₃可用作白色颜料和阻燃剂等。在实验室中可利用SbCl₃的水解反应制取Sb₂O₃(SbCl₃的水解分三步进行,中间产物有SbOCl等),其总反应可表示为2SbCl₃ + 3H₂O$\rightleftharpoons$Sb₂O₃ + 6HCl。
16. (15 分)某研究小组为探究乙酰基磺酸($\mathrm{CH}_3\mathrm{COOSO}_3\mathrm{H}$)制备磺化聚苯乙烯的过程与效果($\mathrm{CH}_3\mathrm{COOSO}_3\mathrm{H}$ 在热水中会水解,产生乙酸和硫酸),进行如下实验:
Ⅰ. 乙酰基磺酸的制备
向装有一定量二氯乙烷溶剂的烧杯中,控制溶液温度在 $10\ ^{\circ}\mathrm{C}$ 以下,边搅拌边分四次加入 $7.6\ \mathrm{mL}$ 乙酸酐$[(\mathrm{CH}_3\mathrm{CO})_2\mathrm{O}]$ 和 $2.7\ \mathrm{mL}$ 浓硫酸,得到乙酰基磺酸溶液。
(1)加入试剂顺序正确的是
a. 先加乙酸酐,再加入浓硫酸
b. 先加浓硫酸,再加乙酸酐
(2)上述过程中,减缓反应速率的措施有
(3)写出生成乙酰基磺酸($\mathrm{CH}_3\mathrm{COOSO}_3\mathrm{H}$)的化学方程式:
Ⅱ. 聚苯乙烯的磺化
按如图所示装置(夹持、加热设备略去),控制反应温度为 $65\ ^{\circ}\mathrm{C}$,缓慢滴加乙酰基磺酸溶液,得到浅棕色液体。将所得浅棕色液体慢慢滴入装有热水的烧杯中,得到淡黄色的磺化聚苯乙烯颗粒,过滤、洗涤、干燥。
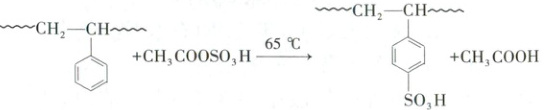
聚苯乙烯的链节与乙酰基磺酸的反应原理如下:
(4)盛装乙酰基磺酸溶液的仪器名称是
(5)一定条件下,$1\ \mathrm{mol}$ 乙酰基磺酸与足量的 $\mathrm{NaOH}$ 溶液反应的化学方程式为
(6)判断产品是否洗涤干净的方法是
Ⅲ. 磺化度的测定
称取 $0.600\ \mathrm{g}$ 干燥的磺化聚苯乙烯样品于锥形瓶,用苯 - 甲醇混合液溶解,以酚酞为指示剂,用 $0.1000\ \mathrm{mol · L}^{-1}\ \mathrm{NaOH}$-甲醇标准溶液滴定至终点,消耗标准液体积为 $10.00\ \mathrm{mL}$,计算磺化度。
已知:i. $\mathrm{R}—\mathrm{SO}_3\mathrm{H} + \mathrm{NaOH} \longrightarrow \mathrm{R}—\mathrm{SO}_3\mathrm{Na} + \mathrm{H}_2\mathrm{O}$。
ii. 聚苯乙烯链节的相对质量为 $104$,磺化聚苯乙烯中含磺酸基链节的相对质量为 $184$。
(7)该样品的磺化度 =
Ⅰ. 乙酰基磺酸的制备
向装有一定量二氯乙烷溶剂的烧杯中,控制溶液温度在 $10\ ^{\circ}\mathrm{C}$ 以下,边搅拌边分四次加入 $7.6\ \mathrm{mL}$ 乙酸酐$[(\mathrm{CH}_3\mathrm{CO})_2\mathrm{O}]$ 和 $2.7\ \mathrm{mL}$ 浓硫酸,得到乙酰基磺酸溶液。
(1)加入试剂顺序正确的是
a
(填序号)。a. 先加乙酸酐,再加入浓硫酸
b. 先加浓硫酸,再加乙酸酐
(2)上述过程中,减缓反应速率的措施有
控制溶液温度在10℃以下;边搅拌边分四次加入
。(3)写出生成乙酰基磺酸($\mathrm{CH}_3\mathrm{COOSO}_3\mathrm{H}$)的化学方程式:
(CH₃CO)₂O + H₂SO₄(浓)$\stackrel{10℃以下}{=}$CH₃COOSO₃H + CH₃COOH
。Ⅱ. 聚苯乙烯的磺化
按如图所示装置(夹持、加热设备略去),控制反应温度为 $65\ ^{\circ}\mathrm{C}$,缓慢滴加乙酰基磺酸溶液,得到浅棕色液体。将所得浅棕色液体慢慢滴入装有热水的烧杯中,得到淡黄色的磺化聚苯乙烯颗粒,过滤、洗涤、干燥。

聚苯乙烯的链节与乙酰基磺酸的反应原理如下:

(4)盛装乙酰基磺酸溶液的仪器名称是
恒压滴液漏斗(1分)
,加热方式为水浴加热(1分)
。(5)一定条件下,$1\ \mathrm{mol}$ 乙酰基磺酸与足量的 $\mathrm{NaOH}$ 溶液反应的化学方程式为
CH₃COOSO₃H + 3NaOH$\stackrel{一定条件}{=}$CH₃COONa + Na₂SO₄ + 2H₂O
。(6)判断产品是否洗涤干净的方法是
取最后一次洗涤液少量于试管中,先加入足量盐酸,再加入氯化钡溶液,若无白色沉淀产生,则产品已洗净
。Ⅲ. 磺化度的测定
称取 $0.600\ \mathrm{g}$ 干燥的磺化聚苯乙烯样品于锥形瓶,用苯 - 甲醇混合液溶解,以酚酞为指示剂,用 $0.1000\ \mathrm{mol · L}^{-1}\ \mathrm{NaOH}$-甲醇标准溶液滴定至终点,消耗标准液体积为 $10.00\ \mathrm{mL}$,计算磺化度。
已知:i. $\mathrm{R}—\mathrm{SO}_3\mathrm{H} + \mathrm{NaOH} \longrightarrow \mathrm{R}—\mathrm{SO}_3\mathrm{Na} + \mathrm{H}_2\mathrm{O}$。
ii. 聚苯乙烯链节的相对质量为 $104$,磺化聚苯乙烯中含磺酸基链节的相对质量为 $184$。
(7)该样品的磺化度 =
20
%(磺化度 = $\frac{含磺酸基链节数}{总链节数} × 100\%$);若样品未充分干燥,将导致测得的磺化度偏低(1分)
(填“偏高”“偏低”或“无偏差”)。
答案:
(除标注外,每空2分,共15分)
(1)a
(2)控制溶液温度在10℃以下;边搅拌边分四次加入
(3)(CH₃CO)₂O + H₂SO₄(浓)$\stackrel{10℃以下}{=}$CH₃COOSO₃H + CH₃COOH
(4)恒压滴液漏斗(1分) 水浴加热(1分)
(5)CH₃COOSO₃H + 3NaOH$\stackrel{一定条件}{=}$CH₃COONa + Na₂SO₄ + 2H₂O
(6)取最后一次洗涤液少量于试管中,先加入足量盐酸,再加入氯化钡溶液,若无白色沉淀产生,则产品已洗净
(7)20 偏低(1分)
必考题型 实验综合题,涉及实验操作、条件控制、化学方程式书写、仪器名称、沉淀是否洗涤干净判定方法、定量分析等
装置解读 球形冷凝管,可冷凝回流,提高原料利用率
乙酰基磺酸溶液 温度计,可监控反应温度,以便将反应温度控制为65℃
恒压滴液漏斗,可缓慢滴加乙酰基磺酸溶液
20g苯乙烯与适量二氯乙烷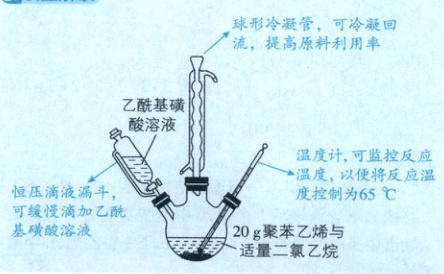
[深度解析]
(1)浓硫酸稀释时会放出大量的热,故应将浓硫酸加入乙酸酐中。
(2)反应速率与反应温度、反应物加入速率等因素有关,故操作中控制溶液温度在10℃以下、边搅拌边分四次加入,均可减缓反应速率。
(3)(CH₃CO)₂O与H₂SO₄在10℃以下发生取代反应生成CH₃COOSO₃H和CH₃COOH。
(4)控制加热温度为65℃,可采用水浴加热。
(5)CH₃COOSO₃H水解生成CH₃COOH和H₂SO₄,故1mol乙酰基磺酸最多消耗3molNaOH,即反应的化学方程式为CH₃COOSO₃H + 3NaOH$\stackrel{一定条件}{=}$CH₃COONa + Na₂SO₄ + 2H₂O。
(6)CH₃COOSO₃H在热水中会水解生成CH₃COOH和H₂SO₄,则要检验产品是否洗涤干净,可检验是否含有H₂SO₄,具体方案见答案。
(7)根据R - SO₃H + NaOH → R - SO₃Na + H₂O可知,样品中含磺酸基链节的物质的量等于消耗的NaOH的物质的量,即为0.1000mol·L⁻¹×10×10⁻³L = 0.001mol,质量为0.001mol×184g·mol⁻¹ = 0.184g,聚苯乙烯链节的物质的量为$\frac{0.416g}{104g·mol⁻¹}$ = 0.004mol,该样品的磺化度为$\frac{0.001mol}{0.001mol + 0.004mol}$×100% = 20%。若样品未充分干燥,样品中水分不与NaOH溶液反应,即计算得到的聚乙烯链节含量增大,磺化度偏低。
(除标注外,每空2分,共15分)
(1)a
(2)控制溶液温度在10℃以下;边搅拌边分四次加入
(3)(CH₃CO)₂O + H₂SO₄(浓)$\stackrel{10℃以下}{=}$CH₃COOSO₃H + CH₃COOH
(4)恒压滴液漏斗(1分) 水浴加热(1分)
(5)CH₃COOSO₃H + 3NaOH$\stackrel{一定条件}{=}$CH₃COONa + Na₂SO₄ + 2H₂O
(6)取最后一次洗涤液少量于试管中,先加入足量盐酸,再加入氯化钡溶液,若无白色沉淀产生,则产品已洗净
(7)20 偏低(1分)
必考题型 实验综合题,涉及实验操作、条件控制、化学方程式书写、仪器名称、沉淀是否洗涤干净判定方法、定量分析等
装置解读 球形冷凝管,可冷凝回流,提高原料利用率
乙酰基磺酸溶液 温度计,可监控反应温度,以便将反应温度控制为65℃
恒压滴液漏斗,可缓慢滴加乙酰基磺酸溶液
20g苯乙烯与适量二氯乙烷

[深度解析]
(1)浓硫酸稀释时会放出大量的热,故应将浓硫酸加入乙酸酐中。
(2)反应速率与反应温度、反应物加入速率等因素有关,故操作中控制溶液温度在10℃以下、边搅拌边分四次加入,均可减缓反应速率。
(3)(CH₃CO)₂O与H₂SO₄在10℃以下发生取代反应生成CH₃COOSO₃H和CH₃COOH。
(4)控制加热温度为65℃,可采用水浴加热。
(5)CH₃COOSO₃H水解生成CH₃COOH和H₂SO₄,故1mol乙酰基磺酸最多消耗3molNaOH,即反应的化学方程式为CH₃COOSO₃H + 3NaOH$\stackrel{一定条件}{=}$CH₃COONa + Na₂SO₄ + 2H₂O。
(6)CH₃COOSO₃H在热水中会水解生成CH₃COOH和H₂SO₄,则要检验产品是否洗涤干净,可检验是否含有H₂SO₄,具体方案见答案。
(7)根据R - SO₃H + NaOH → R - SO₃Na + H₂O可知,样品中含磺酸基链节的物质的量等于消耗的NaOH的物质的量,即为0.1000mol·L⁻¹×10×10⁻³L = 0.001mol,质量为0.001mol×184g·mol⁻¹ = 0.184g,聚苯乙烯链节的物质的量为$\frac{0.416g}{104g·mol⁻¹}$ = 0.004mol,该样品的磺化度为$\frac{0.001mol}{0.001mol + 0.004mol}$×100% = 20%。若样品未充分干燥,样品中水分不与NaOH溶液反应,即计算得到的聚乙烯链节含量增大,磺化度偏低。
17. (14 分)作为重要化工原料,乙烯的制备方法长期以来都是科学家关注的热点领域。回答下列问题:
Ⅰ. 甲烷氧化偶联制乙烯
①$4\mathrm{CH}_4(g) + \mathrm{O}_2(g) \longrightarrow 2\mathrm{C}_2\mathrm{H}_6(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_1 = -354\ \mathrm{kJ · mol}^{-1}$
②$2\mathrm{CH}_4(g) + \mathrm{O}_2(g) \longrightarrow \mathrm{C}_2\mathrm{H}_4(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_2 = -282\ \mathrm{kJ · mol}^{-1}$
③$\mathrm{CH}_4(g) + 2\mathrm{O}_2(g) \longrightarrow \mathrm{CO}_2(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_3 = -803\ \mathrm{kJ · mol}^{-1}$
④$2\mathrm{C}_2\mathrm{H}_6(g) + \mathrm{O}_2(g) \rightleftharpoons 2\mathrm{C}_2\mathrm{H}_4(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_4$
已知:
以乙烯为例,其选择性定义为$\frac{2n_乙烯}{2n_乙烯 + 2n_乙烷 + n_二氧化碳} × 100\%$。
(1)$\Delta H_4 =$
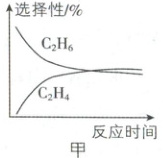
(2)$\mathrm{CH}_4$ 氧化偶联生成 $\mathrm{C}_2\mathrm{H}_4$ 分步进行,$\mathrm{C}_2\mathrm{H}_6$ 和 $\mathrm{C}_2\mathrm{H}_4$ 的选择性随反应时间的变化关系如图甲所示,第一步反应的产物为
(3)为了提高乙烯的产量,科研工作者研制出纳米线催化剂,并且研究了在一定条件下空速(空速是指在规定条件下,单位时间、单位体积催化剂处理的气体量)对反应性能的影响,数据记录如下表所示:
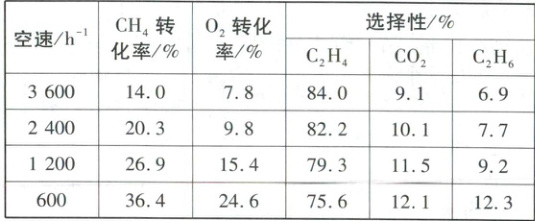
根据上表,请分析工业上选用空速 $600\ \mathrm{h}^{-1}$ 的优缺点:
(4)若 $n(\mathrm{CH}_4):n(\mathrm{O}_2) = 3.5:1$、初始压强为 $450\ \mathrm{kPa}$,在恒容反应器中达到平衡,$\mathrm{CH}_4$ 的转化率为 $30\%$,$\mathrm{C}_2\mathrm{H}_4$ 和 $\mathrm{C}_2\mathrm{H}_6$ 的选择性均为 $40\%$,其余转化为 $\mathrm{CO}_2$。则反应④的平衡常数 $K_\mathrm{p} =$
Ⅱ. 电化学原理制乙烯
科学家利用原电池装置,实现了温室气体 $\mathrm{CO}_2$ 和 $\mathrm{CH}_4$ 的耦合转化制取乙烯,装置如图乙所示。
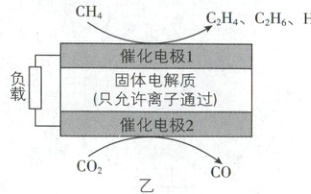
(5)①催化电极 1 除了有 $\mathrm{C}_2\mathrm{H}_4$ 生成外,还有 $\mathrm{C}_2\mathrm{H}_6$ 和少量水产生,则固体电解质为
②经测定,某次实验中共产生 $y\ \mathrm{mol}\ \mathrm{H}_2\mathrm{O}$,则催化电极 2 上转移电子的物质的量为
Ⅰ. 甲烷氧化偶联制乙烯
①$4\mathrm{CH}_4(g) + \mathrm{O}_2(g) \longrightarrow 2\mathrm{C}_2\mathrm{H}_6(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_1 = -354\ \mathrm{kJ · mol}^{-1}$
②$2\mathrm{CH}_4(g) + \mathrm{O}_2(g) \longrightarrow \mathrm{C}_2\mathrm{H}_4(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_2 = -282\ \mathrm{kJ · mol}^{-1}$
③$\mathrm{CH}_4(g) + 2\mathrm{O}_2(g) \longrightarrow \mathrm{CO}_2(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_3 = -803\ \mathrm{kJ · mol}^{-1}$
④$2\mathrm{C}_2\mathrm{H}_6(g) + \mathrm{O}_2(g) \rightleftharpoons 2\mathrm{C}_2\mathrm{H}_4(g) + 2\mathrm{H}_2\mathrm{O}(g)\ \ \Delta H_4$
已知:
以乙烯为例,其选择性定义为$\frac{2n_乙烯}{2n_乙烯 + 2n_乙烷 + n_二氧化碳} × 100\%$。
(1)$\Delta H_4 =$
-210
$\mathrm{kJ · mol}^{-1}$,反应④能
(填“能”或“不能”)自发进行。(2)$\mathrm{CH}_4$ 氧化偶联生成 $\mathrm{C}_2\mathrm{H}_4$ 分步进行,$\mathrm{C}_2\mathrm{H}_6$ 和 $\mathrm{C}_2\mathrm{H}_4$ 的选择性随反应时间的变化关系如图甲所示,第一步反应的产物为
C₂H₆
。
(3)为了提高乙烯的产量,科研工作者研制出纳米线催化剂,并且研究了在一定条件下空速(空速是指在规定条件下,单位时间、单位体积催化剂处理的气体量)对反应性能的影响,数据记录如下表所示:

根据上表,请分析工业上选用空速 $600\ \mathrm{h}^{-1}$ 的优缺点:
优点是空速降低,原料气与催化剂充分接触,催化效果更好,反应更充分,乙烯的产率更高;缺点是接触时间长,副反应会变多,导致乙烯的选择性降低
。(4)若 $n(\mathrm{CH}_4):n(\mathrm{O}_2) = 3.5:1$、初始压强为 $450\ \mathrm{kPa}$,在恒容反应器中达到平衡,$\mathrm{CH}_4$ 的转化率为 $30\%$,$\mathrm{C}_2\mathrm{H}_4$ 和 $\mathrm{C}_2\mathrm{H}_6$ 的选择性均为 $40\%$,其余转化为 $\mathrm{CO}_2$。则反应④的平衡常数 $K_\mathrm{p} =$
416
$\mathrm{kPa}$(保留整数)。Ⅱ. 电化学原理制乙烯
科学家利用原电池装置,实现了温室气体 $\mathrm{CO}_2$ 和 $\mathrm{CH}_4$ 的耦合转化制取乙烯,装置如图乙所示。

(5)①催化电极 1 除了有 $\mathrm{C}_2\mathrm{H}_4$ 生成外,还有 $\mathrm{C}_2\mathrm{H}_6$ 和少量水产生,则固体电解质为
氧离子导体
(填“氧离子导体”或“质子导体”)。②经测定,某次实验中共产生 $y\ \mathrm{mol}\ \mathrm{H}_2\mathrm{O}$,则催化电极 2 上转移电子的物质的量为
2y
$\mathrm{mol}$(用含 $y$ 的式子表示)。
答案:
(每空2分,共14分)
(1)-210 能
(2)C₂H₆
(3)优点是空速降低,原料气与催化剂充分接触,催化效果更好,反应更充分,乙烯的产率更高;缺点是接触时间长,副反应会变多,导致乙烯的选择性降低
(4)416
(5)①氧离子导体
②2y
必考题型 化学反应原理综合题,涉及盖斯定律、反应自发性判断、反应产物判断、平衡常数的计算、原电池工作原理及计算等
[深度解析]
(1)反应②×2 - 反应① = 反应④,则由盖斯定律可知,ΔH₄ = (-282kJ·mol⁻¹)×2 - (-354kJ·mol⁻¹) = -210kJ·mol⁻¹,该反应是熵增的放热反应,任何条件下,ΔG = ΔH - TΔS均小于0,均能自发进行。
(2)由题图甲可知,起始时乙烷的选择性大于乙烯的选择性,说明第一步反应的产物为乙烷。
(3)乙烯的产率 = 甲烷的转化率×乙烯的选择性,根据表中数据可知,甲烷转化率随着空速降低逐渐增大,乙烯的选择性随空速降低逐渐减小,空速降低,催化剂与原料气充分接触,催化效果更好,反应更充分,使得甲烷的转化率更高,但是接触时间长,副反应会变多,导致乙烯的选择性降低。
(4)设起始CH₄、O₂的物质的量分别为3.5mol、1mol,平衡时CH₄的转化率为30%,C₂H₆和C₂H₄的选择性均为40%,则平衡时n(CH₄) = 3.5mol - 3.5mol×30% = 2.45mol,n(C₂H₆) = n(C₂H₄) = 3.5mol×30%×40%×$\frac{1}{2}$ = 0.21mol,根据碳原子守恒可知,n(CO₂) = 3.5mol - 2.45mol - 0.21mol×2 - 0.21mol×2 = 0.21mol,根据氢原子守恒可知,n[H₂O(g)] = 3.5mol×4 - 2.45mol×4 - 0.21mol×6 - 0.21mol×4 = 1.05mol,根据氧原子守恒可知,n(O₂) = $\frac{1mol×2 - 0.21mol×2 - 1.05mol}{2}$ = 0.265mol,则平衡时混合气体的总物质的量 = (2.45 + 0.21 + 0.21 + 0.21 + 1.05 + 0.265)mol = 4.395mol,根据恒容容器中物质的量之比等于压强之比可知,平衡时体系总压强为$\frac{4.395mol×450kPa}{4.5mol}$ = 439.5kPa,则反应④的平衡常数Kₚ = $\frac{(\frac{0.21}{4.395}×439.5kPa)²×(\frac{1.05}{4.395}×439.5kPa)}{(\frac{0.21}{4.395}×439.5kPa)²×(\frac{0.265}{4.395}×439.5kPa)}$≈416kPa。
(5)①在催化电极1上,CH₄转化为C₂H₄、C₂H₆和H₂O,两电极之间的固体电解质只允许离子通过,结合原子守恒可知该固体电解质为氧离子导体。②催化电极1上,C元素失电子,发生氧化反应,该电极作负极,电极反应为2CH₄ - 4e⁻ + 2O²⁻ = C₂H₄ + 2H₂O、2CH₄ - 2e⁻ + O²⁻ = C₂H₆ + H₂O,催化电极2上,CO₂转化为CO,C元素化合价降低,得电子,该电极作正极,电极反应为CO₂ + 2e⁻ = CO + O²⁻,可得:O²⁻~H₂O~2e⁻,实验中共产生ymolH₂O,则转移的电子的物质的量为2ymol。
快解 第
(4)问根据产物中乙烯和乙烷的选择性可知,二氧化碳选择性为20%,n(CO₂) = 3.5mol×30%×(1 - 40%×2) = 0.21mol。
(1)-210 能
(2)C₂H₆
(3)优点是空速降低,原料气与催化剂充分接触,催化效果更好,反应更充分,乙烯的产率更高;缺点是接触时间长,副反应会变多,导致乙烯的选择性降低
(4)416
(5)①氧离子导体
②2y
必考题型 化学反应原理综合题,涉及盖斯定律、反应自发性判断、反应产物判断、平衡常数的计算、原电池工作原理及计算等
[深度解析]
(1)反应②×2 - 反应① = 反应④,则由盖斯定律可知,ΔH₄ = (-282kJ·mol⁻¹)×2 - (-354kJ·mol⁻¹) = -210kJ·mol⁻¹,该反应是熵增的放热反应,任何条件下,ΔG = ΔH - TΔS均小于0,均能自发进行。
(2)由题图甲可知,起始时乙烷的选择性大于乙烯的选择性,说明第一步反应的产物为乙烷。
(3)乙烯的产率 = 甲烷的转化率×乙烯的选择性,根据表中数据可知,甲烷转化率随着空速降低逐渐增大,乙烯的选择性随空速降低逐渐减小,空速降低,催化剂与原料气充分接触,催化效果更好,反应更充分,使得甲烷的转化率更高,但是接触时间长,副反应会变多,导致乙烯的选择性降低。
(4)设起始CH₄、O₂的物质的量分别为3.5mol、1mol,平衡时CH₄的转化率为30%,C₂H₆和C₂H₄的选择性均为40%,则平衡时n(CH₄) = 3.5mol - 3.5mol×30% = 2.45mol,n(C₂H₆) = n(C₂H₄) = 3.5mol×30%×40%×$\frac{1}{2}$ = 0.21mol,根据碳原子守恒可知,n(CO₂) = 3.5mol - 2.45mol - 0.21mol×2 - 0.21mol×2 = 0.21mol,根据氢原子守恒可知,n[H₂O(g)] = 3.5mol×4 - 2.45mol×4 - 0.21mol×6 - 0.21mol×4 = 1.05mol,根据氧原子守恒可知,n(O₂) = $\frac{1mol×2 - 0.21mol×2 - 1.05mol}{2}$ = 0.265mol,则平衡时混合气体的总物质的量 = (2.45 + 0.21 + 0.21 + 0.21 + 1.05 + 0.265)mol = 4.395mol,根据恒容容器中物质的量之比等于压强之比可知,平衡时体系总压强为$\frac{4.395mol×450kPa}{4.5mol}$ = 439.5kPa,则反应④的平衡常数Kₚ = $\frac{(\frac{0.21}{4.395}×439.5kPa)²×(\frac{1.05}{4.395}×439.5kPa)}{(\frac{0.21}{4.395}×439.5kPa)²×(\frac{0.265}{4.395}×439.5kPa)}$≈416kPa。
(5)①在催化电极1上,CH₄转化为C₂H₄、C₂H₆和H₂O,两电极之间的固体电解质只允许离子通过,结合原子守恒可知该固体电解质为氧离子导体。②催化电极1上,C元素失电子,发生氧化反应,该电极作负极,电极反应为2CH₄ - 4e⁻ + 2O²⁻ = C₂H₄ + 2H₂O、2CH₄ - 2e⁻ + O²⁻ = C₂H₆ + H₂O,催化电极2上,CO₂转化为CO,C元素化合价降低,得电子,该电极作正极,电极反应为CO₂ + 2e⁻ = CO + O²⁻,可得:O²⁻~H₂O~2e⁻,实验中共产生ymolH₂O,则转移的电子的物质的量为2ymol。
快解 第
(4)问根据产物中乙烯和乙烷的选择性可知,二氧化碳选择性为20%,n(CO₂) = 3.5mol×30%×(1 - 40%×2) = 0.21mol。
查看更多完整答案,请扫码查看


