2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. (14分)铬的化合物应用广泛,工业上以铬铁矿(主
要成分为${FeCr_{2}O_{4}}$,含${Al}$、${Si}$氧化物等杂质)为主要
原料制备红矾钠(${Na_{2}Cr_{2}O_{7}· 2H_{2}O}$)的工艺流程如图甲所示。

请回答下列问题:
(1)铬元素在元素周期表中的位置为。
(2)“中和”步骤所得的“滤渣2”的主要成分为(填化学式)。
(3)常温下,矿物中相关元素可溶性组分物质的量浓度
的对数$[\lg c/(mol· L^{-1})]$与${pH}$的关系如图乙所示。当
溶液中可溶性组分浓度$c \leqslant 1.0× 10^{-5}\ mol· L^{-1}$时,可认
为已除尽,则“中和”时${pH}$的理论范围为。

(4)通入过量的${CO_{2}}$代替硫酸也能实现“酸化”目
的,利用${CO_{2}}$酸化的优点是。

(5)已知${Na_{2}Cr_{2}O_{7}}$、${Na_{2}SO_{4}}$的溶解度曲线如图丙所示,
则工艺流程中所得“副产品”为(填化学
式);为获取“副产品”,流程中“蒸发结晶”与“冷却结
晶”之间还省略了一步操作,该操作名称是。
(6)工业上常用电解法处理含${Cr_{2}O^{2-}_{7}}$的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生${Fe(OH)_{3}}$和${Cr(OH)_{3}}$沉淀。写出电解槽中溶液析出沉淀的离子
方程式:。
要成分为${FeCr_{2}O_{4}}$,含${Al}$、${Si}$氧化物等杂质)为主要
原料制备红矾钠(${Na_{2}Cr_{2}O_{7}· 2H_{2}O}$)的工艺流程如图甲所示。

请回答下列问题:
(1)铬元素在元素周期表中的位置为。
(2)“中和”步骤所得的“滤渣2”的主要成分为(填化学式)。
(3)常温下,矿物中相关元素可溶性组分物质的量浓度
的对数$[\lg c/(mol· L^{-1})]$与${pH}$的关系如图乙所示。当
溶液中可溶性组分浓度$c \leqslant 1.0× 10^{-5}\ mol· L^{-1}$时,可认
为已除尽,则“中和”时${pH}$的理论范围为。

(4)通入过量的${CO_{2}}$代替硫酸也能实现“酸化”目
的,利用${CO_{2}}$酸化的优点是。

(5)已知${Na_{2}Cr_{2}O_{7}}$、${Na_{2}SO_{4}}$的溶解度曲线如图丙所示,
则工艺流程中所得“副产品”为(填化学
式);为获取“副产品”,流程中“蒸发结晶”与“冷却结
晶”之间还省略了一步操作,该操作名称是。
(6)工业上常用电解法处理含${Cr_{2}O^{2-}_{7}}$的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生${Fe(OH)_{3}}$和${Cr(OH)_{3}}$沉淀。写出电解槽中溶液析出沉淀的离子
方程式:。
答案:
(1)第四周期第ⅥB族
(2)Al(OH)₃、H₂SiO₃
(3)4.5 ≤ pH ≤ 9.3(或4.5~9.3)
(4)CO₂廉价易得,来源更丰富(或析出的白色晶体NaHCO₃加热分解生成Na₂CO₃和CO₂,可以循环使用或酸性弱可减少设备的腐蚀,合理即可)
(5)Na₂SO₄ 趁热过滤
(6)6Fe²⁺ + Cr₂O₇²⁻ + 17H₂O = 6Fe(OH)₃↓ + 2Cr(OH)₃↓ + 10H⁺
(1)第四周期第ⅥB族
(2)Al(OH)₃、H₂SiO₃
(3)4.5 ≤ pH ≤ 9.3(或4.5~9.3)
(4)CO₂廉价易得,来源更丰富(或析出的白色晶体NaHCO₃加热分解生成Na₂CO₃和CO₂,可以循环使用或酸性弱可减少设备的腐蚀,合理即可)
(5)Na₂SO₄ 趁热过滤
(6)6Fe²⁺ + Cr₂O₇²⁻ + 17H₂O = 6Fe(OH)₃↓ + 2Cr(OH)₃↓ + 10H⁺
16. (14分)氨基羧酸盐在工业、农业、生活中都有着十分
广泛的应用。氨基甲酸铵(${NH_{2}COONH_{4}}$)可用作肥料、
灭火剂、洗涤剂等,甘氨酸亚铁${[(NH_{2}CH_{2}COO)_{2}Fe]}$可
用作补铁剂等。已知:

Ⅰ. 制备氨基甲酸铵
反应的化学方程式为${2NH_{3}(g) + CO_{2}(g) ⇌ NH_{2}COONH_{4}(g)}$ $\Delta H < 0$。制备装置如图甲,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵微小晶体悬浮在四氯化碳中(注:四氯化碳与液体石蜡均为惰性介质)。
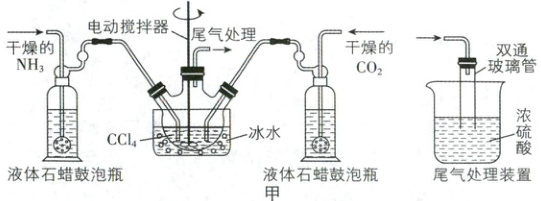
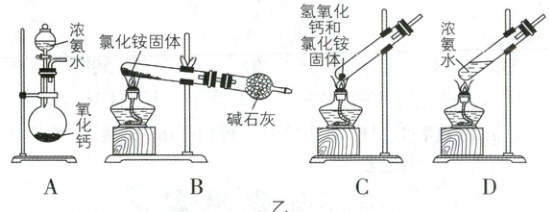
(1)若用图乙装置和选用的试剂制取氨气,其中错误
的是(填序号)。
(2)水槽中冰水的作用:①防止氨基甲酸铵分解;
②。
(3)下列说法不正确的是(填序号)。
A. 甘氨酸在乙醇中溶解度小于在水中,可能的原因
是甘氨酸能形成内盐
B. 尾气处理装置中双通玻璃管可防止倒吸
C. 取氨基甲酸铵固体于恒温的刚性容器中发生分解,
当氨气的体积分数不变时说明反应达到平衡状态
D. 尾气处理装置中,浓硫酸至少有两个作用
E. 液体石蜡鼓泡瓶便于观察气体的流速,从而有利
于控制气体的流量,提高原料的利用率
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
0.782 0 g,用足量石灰水充分处理后,使碳元素完全
转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。
则样品中氨基甲酸铵的物质的量分数为(保留两位有效数字)。
Ⅱ. 制备${(NH_{2}CH_{2}COO)_{2}Fe}$
①配制含0.10 mol ${FeSO_{4}}$的水溶液;
②制备${FeCO_{3}}$:向配制好的${FeSO_{4}}$溶液中,缓慢加入
200 mL $1.1\ mol· L^{-1}\ {NH_{4}HCO_{3}}$溶液,边加边搅拌,
反应结束后过滤并洗涤沉淀;
③制备${(NH_{2}CH_{2}COO)_{2}Fe}$:实验装置如图丙所示(夹
持和加热仪器已省略),装置C三颈烧瓶中盛有
0.1 mol ${FeCO_{3}}$、200 mL $1.0\ mol· L^{-1}$甘氨酸溶液和
适量柠檬酸,然后利用A中的反应将C中空气排尽,
接着通过仪器b向C中加入适量氢氧化钠溶液调节
${pH}$到6左右。反应结束后过滤,滤液经冷却结晶、
过滤、洗涤、干燥后得到产品。
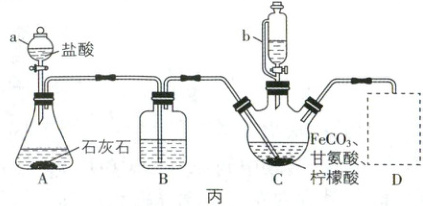
(5)若装置D为 ,盛装的溶液为澄清石灰水,其
,盛装的溶液为澄清石灰水,其
作用为。
(6)生成${FeCO_{3}}$沉淀的离子方程式为。
(7)经实验研究后发现体系${pH \approx 6}$时,${(NH_{2}CH_{2}COO)_{2}Fe}$
产量最高,原因是。
广泛的应用。氨基甲酸铵(${NH_{2}COONH_{4}}$)可用作肥料、
灭火剂、洗涤剂等,甘氨酸亚铁${[(NH_{2}CH_{2}COO)_{2}Fe]}$可
用作补铁剂等。已知:

实
验
室制备方法如下:Ⅰ. 制备氨基甲酸铵
反应的化学方程式为${2NH_{3}(g) + CO_{2}(g) ⇌ NH_{2}COONH_{4}(g)}$ $\Delta H < 0$。制备装置如图甲,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵微小晶体悬浮在四氯化碳中(注:四氯化碳与液体石蜡均为惰性介质)。

(1)若用图乙装置和选用的试剂制取氨气,其中错误
的是(填序号)。

(2)水槽中冰水的作用:①防止氨基甲酸铵分解;
②。
(3)下列说法不正确的是(填序号)。
A. 甘氨酸在乙醇中溶解度小于在水中,可能的原因
是甘氨酸能形成内盐
B. 尾气处理装置中双通玻璃管可防止倒吸
C. 取氨基甲酸铵固体于恒温的刚性容器中发生分解,
当氨气的体积分数不变时说明反应达到平衡状态
D. 尾气处理装置中,浓硫酸至少有两个作用
E. 液体石蜡鼓泡瓶便于观察气体的流速,从而有利
于控制气体的流量,提高原料的利用率
(4)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品
0.782 0 g,用足量石灰水充分处理后,使碳元素完全
转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。
则样品中氨基甲酸铵的物质的量分数为(保留两位有效数字)。
Ⅱ. 制备${(NH_{2}CH_{2}COO)_{2}Fe}$
①配制含0.10 mol ${FeSO_{4}}$的水溶液;
②制备${FeCO_{3}}$:向配制好的${FeSO_{4}}$溶液中,缓慢加入
200 mL $1.1\ mol· L^{-1}\ {NH_{4}HCO_{3}}$溶液,边加边搅拌,
反应结束后过滤并洗涤沉淀;
③制备${(NH_{2}CH_{2}COO)_{2}Fe}$:实验装置如图丙所示(夹
持和加热仪器已省略),装置C三颈烧瓶中盛有
0.1 mol ${FeCO_{3}}$、200 mL $1.0\ mol· L^{-1}$甘氨酸溶液和
适量柠檬酸,然后利用A中的反应将C中空气排尽,
接着通过仪器b向C中加入适量氢氧化钠溶液调节
${pH}$到6左右。反应结束后过滤,滤液经冷却结晶、
过滤、洗涤、干燥后得到产品。

(5)若装置D为
 ,盛装的溶液为澄清石灰水,其
,盛装的溶液为澄清石灰水,其作用为。
(6)生成${FeCO_{3}}$沉淀的离子方程式为。
(7)经实验研究后发现体系${pH \approx 6}$时,${(NH_{2}CH_{2}COO)_{2}Fe}$
产量最高,原因是。
答案:
(1)BC
(2)降低温度,使制备氨基甲酸铵反应的平衡正向移动,提高氨基甲酸铵的产率(合理即可)
(3)C
(4)80%(或0.80)
(5)检验装置中的空气是否排尽
(6)Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O
(7)pH > 6,容易产生Fe(OH)₂杂质;pH < 6,甘氨酸亚铁会溶于酸(或甘氨酸电离出的NH₂CH₂COO⁻浓度较低,不利于甘氨酸亚铁形成)
(1)BC
(2)降低温度,使制备氨基甲酸铵反应的平衡正向移动,提高氨基甲酸铵的产率(合理即可)
(3)C
(4)80%(或0.80)
(5)检验装置中的空气是否排尽
(6)Fe²⁺ + 2HCO₃⁻ = FeCO₃↓ + CO₂↑ + H₂O
(7)pH > 6,容易产生Fe(OH)₂杂质;pH < 6,甘氨酸亚铁会溶于酸(或甘氨酸电离出的NH₂CH₂COO⁻浓度较低,不利于甘氨酸亚铁形成)
查看更多完整答案,请扫码查看


