2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
16. (14 分) 钴在新能源、新材料领域的核心用途集中在
电池材料和高温合金。某炼锌废渣含有钙、镁、铅、
铜、铁、钴、锰的 +2 价氧化物及铜的单质。从该废渣
中提取钴的一种流程如下:

回答下列问题:
(1) 钴元素位于元素周期表第 周期第 族。
(2) 浸渣的成分除铜外,还有 。
(3) “除铜” 步骤中,发生反应的化学方程式为 。
(4) “除杂 Ⅱ” 步骤得到的滤渣 2 是 MnO₂,适量
Na₂S₂O₈ 的作用有 ,
Na₂S₂O₈ 中含有过氧键 “—O—O—”,则其中 -1 价和
-2 价的氧原子个数之比为 。
(5) “除杂 Ⅲ” 步骤需加入 CoO 调节 pH = 4,该步骤
反应的离子方程式为 。
(6) “沉钴” 步骤得到的产品是 Co(OH)₃,产生的滤
液应该返回到 步骤。
电池材料和高温合金。某炼锌废渣含有钙、镁、铅、
铜、铁、钴、锰的 +2 价氧化物及铜的单质。从该废渣
中提取钴的一种流程如下:

回答下列问题:
(1) 钴元素位于元素周期表第 周期第 族。
(2) 浸渣的成分除铜外,还有 。
(3) “除铜” 步骤中,发生反应的化学方程式为 。
(4) “除杂 Ⅱ” 步骤得到的滤渣 2 是 MnO₂,适量
Na₂S₂O₈ 的作用有 ,
Na₂S₂O₈ 中含有过氧键 “—O—O—”,则其中 -1 价和
-2 价的氧原子个数之比为 。
(5) “除杂 Ⅲ” 步骤需加入 CoO 调节 pH = 4,该步骤
反应的离子方程式为 。
(6) “沉钴” 步骤得到的产品是 Co(OH)₃,产生的滤
液应该返回到 步骤。
答案:
16.(除标注外,每空2分,共14分)
(1)四(1分) Ⅷ(1分)
(2)PbSO₄、CaSO₄
(3)CuSO₄ + H₂S = CuS↓+ H₂SO₄
(4)将Mn²⁺转化为MnO₂除去;将Fe²⁺氧化为Fe³⁺ 1:3
(5)2Fe³⁺ + 3CoO + 3H₂O = 2Fe(OH)₃↓+ 3Co²⁺[或3CoO + Fe³⁺ + 3H⁺ = 3Co²⁺ + Fe(OH)₃↓]
(6)酸浸
必考题型工艺流程,涉及元素在周期表中的位置、反应方程式书写、试剂作用等
流程分析:
原料:炼锌废渣(含CaO、MgO、PbO、CuO、FeO、CoO、MnO及Cu单质)
目标元素:钴
除杂元素:钙、镁、铅、铜、铁、锰
酸浸:炼锌废渣中加入硫酸,金属氧化物转化为对应的硫酸盐,MgSO₄、FeSO₄、CoSO₄、MnSO₄、CuSO₄可溶,进入浸出液中,CaSO₄微溶,在浸出液、浸渣中均有,Cu、PbSO₄难溶,进入浸渣;
除杂Ⅰ:向浸出液中加入NaF,CaSO₄、MgSO₄转化为CaF₂、MgF₂进入滤渣1,Fe²⁺、Co²⁺、Mn²⁺、Cu²⁺进入滤液;
除铜:向滤液中加入H₂S,Cu²⁺转化为CuS沉淀进入滤渣,Fe²⁺、Co²⁺、Mn²⁺进入滤液;
除杂Ⅱ:向滤液中加入适量Na₂S₂O₈,Mn²⁺被Na₂S₂O₈氧化生成MnO₂进入滤渣2,Fe²⁺被Na₂S₂O₈氧化生成Fe³⁺,Na₂S₂O₈被还原为SO₄²⁻,Fe³⁺、Co²⁺、SO₄²⁻进入滤液;
除杂Ⅲ:向滤液中加CoO调节pH = 4,促进Fe³⁺的水解生成Fe(OH)₃进入滤渣3;
沉钴:向滤液中加入NaClO,将Co²⁺氧化为Co(OH)₃,过滤获得产品Co(OH)₃沉淀,滤液中含有NaCl、H₂SO₄。
[深度解析]
(1)钴元素的原子序数为27,周期序数 = 电子层数 = 4,价层电子排布为3d⁷4s²,属于过渡元素,位于第Ⅷ族。
(2)废渣中PbO与H₂SO₄反应生成难溶的PbSO₄,CaO与H₂SO₄反应生成微溶的CaSO₄,Cu不与H₂SO₄反应,故浸渣为Cu、CaSO₄、PbSO₄。
(3)CuS不溶于稀硫酸,故CuSO₄与H₂S反应生成CuS和H₂SO₄,化学方程式为CuSO₄ + H₂S = CuS↓+ H₂SO₄。
(4)Na₂S₂O₈中S为 + 6价、Na为 + 1价,设 - 1价氧个数为x、 - 2价氧个数为y,根据物质电中性和氧原子总数可列方程:2×1 + 2×6 = x + 2y、x + y = 8,解得x = 2、y = 6, - 1价和 - 2价氧原子个数之比为1:3。
(5)加入CoO与H⁺反应,促进Fe³⁺的水解,使得Fe³⁺转化为Fe(OH)₃,以除去Fe元素。
(6)“沉钴”后滤液含H₂SO₄,可返回到“酸浸”步骤重复利用,提高原料利用率。
(1)四(1分) Ⅷ(1分)
(2)PbSO₄、CaSO₄
(3)CuSO₄ + H₂S = CuS↓+ H₂SO₄
(4)将Mn²⁺转化为MnO₂除去;将Fe²⁺氧化为Fe³⁺ 1:3
(5)2Fe³⁺ + 3CoO + 3H₂O = 2Fe(OH)₃↓+ 3Co²⁺[或3CoO + Fe³⁺ + 3H⁺ = 3Co²⁺ + Fe(OH)₃↓]
(6)酸浸
必考题型工艺流程,涉及元素在周期表中的位置、反应方程式书写、试剂作用等
流程分析:
原料:炼锌废渣(含CaO、MgO、PbO、CuO、FeO、CoO、MnO及Cu单质)
目标元素:钴
除杂元素:钙、镁、铅、铜、铁、锰
酸浸:炼锌废渣中加入硫酸,金属氧化物转化为对应的硫酸盐,MgSO₄、FeSO₄、CoSO₄、MnSO₄、CuSO₄可溶,进入浸出液中,CaSO₄微溶,在浸出液、浸渣中均有,Cu、PbSO₄难溶,进入浸渣;
除杂Ⅰ:向浸出液中加入NaF,CaSO₄、MgSO₄转化为CaF₂、MgF₂进入滤渣1,Fe²⁺、Co²⁺、Mn²⁺、Cu²⁺进入滤液;
除铜:向滤液中加入H₂S,Cu²⁺转化为CuS沉淀进入滤渣,Fe²⁺、Co²⁺、Mn²⁺进入滤液;
除杂Ⅱ:向滤液中加入适量Na₂S₂O₈,Mn²⁺被Na₂S₂O₈氧化生成MnO₂进入滤渣2,Fe²⁺被Na₂S₂O₈氧化生成Fe³⁺,Na₂S₂O₈被还原为SO₄²⁻,Fe³⁺、Co²⁺、SO₄²⁻进入滤液;
除杂Ⅲ:向滤液中加CoO调节pH = 4,促进Fe³⁺的水解生成Fe(OH)₃进入滤渣3;
沉钴:向滤液中加入NaClO,将Co²⁺氧化为Co(OH)₃,过滤获得产品Co(OH)₃沉淀,滤液中含有NaCl、H₂SO₄。
[深度解析]
(1)钴元素的原子序数为27,周期序数 = 电子层数 = 4,价层电子排布为3d⁷4s²,属于过渡元素,位于第Ⅷ族。
(2)废渣中PbO与H₂SO₄反应生成难溶的PbSO₄,CaO与H₂SO₄反应生成微溶的CaSO₄,Cu不与H₂SO₄反应,故浸渣为Cu、CaSO₄、PbSO₄。
(3)CuS不溶于稀硫酸,故CuSO₄与H₂S反应生成CuS和H₂SO₄,化学方程式为CuSO₄ + H₂S = CuS↓+ H₂SO₄。
(4)Na₂S₂O₈中S为 + 6价、Na为 + 1价,设 - 1价氧个数为x、 - 2价氧个数为y,根据物质电中性和氧原子总数可列方程:2×1 + 2×6 = x + 2y、x + y = 8,解得x = 2、y = 6, - 1价和 - 2价氧原子个数之比为1:3。
(5)加入CoO与H⁺反应,促进Fe³⁺的水解,使得Fe³⁺转化为Fe(OH)₃,以除去Fe元素。
(6)“沉钴”后滤液含H₂SO₄,可返回到“酸浸”步骤重复利用,提高原料利用率。
17. (14 分) 甘氨酸亚铁[Fe(H₂NCH₂COO)₂] 是一种新
型补铁剂,被用于治疗缺铁性贫血。某化学兴趣小
组对甘氨酸亚铁的制备和相关性质进行探究,并对
产品中甘氨酸亚铁的含量进行了测定。
已知:①甘氨酸(H₂NCH₂COOH)易溶于水,微溶于乙醇。
②甘氨酸亚铁易溶于水,难溶于乙醇。
③螯合物因成环结构产生螯合效应,而螯合效应能
提高配合物的化学稳定性。
请回答下列问题:
Ⅰ. 制备甘氨酸亚铁
用图甲所示的反应装置(三颈烧瓶的中间瓶口与空
气相通,夹持装置已省略)制备甘氨酸亚铁。将
15.0 g 甘氨酸、30.0 g 硫酸亚铁晶体(FeSO₄·7H₂O,
Mᵣ = 278)依次加入三颈烧瓶中,再加入 200 mL 蒸馏
水,搅拌使固体完全溶解。然后向其中缓慢滴加
1 mol·L⁻¹ 的碳酸钠溶液,当溶液 pH 约为 5.0 时停
止滴加。控制温度在 50~60 ℃,持续搅拌反应 0.5~
1 h。关闭电磁搅拌加热器,停止通氮气,将反应液
静置陈化 1~2 h。
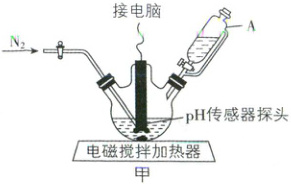
(1) 仪器 A 的名称是 。
(2) 在实验过程中持续通入 N₂,目的是
。反应装置中制备甘氨酸亚铁的化学方程
式为 。
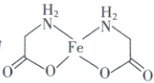
(3) 已知甘氨酸亚铁[Fe(H₂NCH₂COO)₂] 结构中含
有 2 个五元环,写出甘氨酸亚铁的结构简式:
。
(4) 反应结束后,向静置陈化后的反应液中加入
(填试剂名称),过滤,得到甘氨酸亚铁
粗品。
(5) 该实验需要控制溶液的 pH 在 5.0 左右,pH 不宜
过高的原因是 。
(6) 将甘氨酸亚铁与硫酸亚铁分别配制成相同浓度
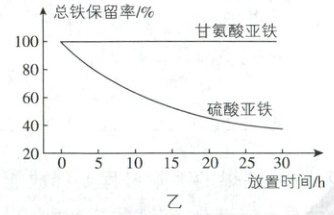
的溶液,调节 pH 为 5.0,放置一段时间。放置过程
中,间隔相同时间取样测定溶液中总铁保留率情况,
得到图乙所示图像,从该图像可得出的结论是
。
Ⅱ. 测定产品中甘氨酸亚铁的含量
将甘氨酸亚铁粗品放入真空干燥箱,60 ℃ 干燥 4~5 h。
取出固体产品进行称重,产品的质量为 16.3 g。然
后,用滴定法测定产品中甘氨酸亚铁的含量,经计算
得出甘氨酸亚铁的质量为 15.9 g。
(7) 甘氨酸亚铁的产率为 (保留 3 位有效数字)。
型补铁剂,被用于治疗缺铁性贫血。某化学兴趣小
组对甘氨酸亚铁的制备和相关性质进行探究,并对
产品中甘氨酸亚铁的含量进行了测定。
已知:①甘氨酸(H₂NCH₂COOH)易溶于水,微溶于乙醇。
②甘氨酸亚铁易溶于水,难溶于乙醇。
③螯合物因成环结构产生螯合效应,而螯合效应能
提高配合物的化学稳定性。
请回答下列问题:
Ⅰ. 制备甘氨酸亚铁
用图甲所示的反应装置(三颈烧瓶的中间瓶口与空
气相通,夹持装置已省略)制备甘氨酸亚铁。将
15.0 g 甘氨酸、30.0 g 硫酸亚铁晶体(FeSO₄·7H₂O,
Mᵣ = 278)依次加入三颈烧瓶中,再加入 200 mL 蒸馏
水,搅拌使固体完全溶解。然后向其中缓慢滴加
1 mol·L⁻¹ 的碳酸钠溶液,当溶液 pH 约为 5.0 时停
止滴加。控制温度在 50~60 ℃,持续搅拌反应 0.5~
1 h。关闭电磁搅拌加热器,停止通氮气,将反应液
静置陈化 1~2 h。

(1) 仪器 A 的名称是 。
(2) 在实验过程中持续通入 N₂,目的是
。反应装置中制备甘氨酸亚铁的化学方程
式为 。
(3) 已知甘氨酸亚铁[Fe(H₂NCH₂COO)₂] 结构中含
有 2 个五元环,写出甘氨酸亚铁的结构简式:
。
(4) 反应结束后,向静置陈化后的反应液中加入
(填试剂名称),过滤,得到甘氨酸亚铁
粗品。
(5) 该实验需要控制溶液的 pH 在 5.0 左右,pH 不宜
过高的原因是 。
(6) 将甘氨酸亚铁与硫酸亚铁分别配制成相同浓度
的溶液,调节 pH 为 5.0,放置一段时间。放置过程
中,间隔相同时间取样测定溶液中总铁保留率情况,
得到图乙所示图像,从该图像可得出的结论是
。

Ⅱ. 测定产品中甘氨酸亚铁的含量
将甘氨酸亚铁粗品放入真空干燥箱,60 ℃ 干燥 4~5 h。
取出固体产品进行称重,产品的质量为 16.3 g。然
后,用滴定法测定产品中甘氨酸亚铁的含量,经计算
得出甘氨酸亚铁的质量为 15.9 g。
(7) 甘氨酸亚铁的产率为 (保留 3 位有效数字)。
答案:
17.(除标注外,每空2分,共14分)
(1)恒压滴液漏斗
(2)排出装置内的空气,防止Fe²⁺被氧化(1分)
2H₂NCH₂COOH + FeSO₄ + Na₂CO₃ = Fe(H₂NCH₂COO)₂ + Na₂SO₄ + H₂O + CO₂↑
(3)
(4)乙醇(1分)
(5)溶液pH过高,会生成Fe(OH)₂沉淀,导致产品纯度下降
(6)甘氨酸亚铁因螯合效应更稳定,Fe²⁺不易被氧化,也不易水解
(7)77.9%
必考题型化学实验综合,涉及实验仪器的识别、实验操作目的、化学方程式书写、结构简式书写、实验条件控制、产率计算等
装置解读: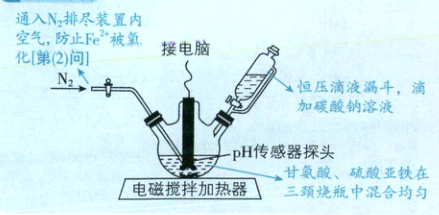
[深度解析]
(1)仪器A为恒压滴液漏斗,可平衡漏斗内外压强,使液体顺利滴下。
(2)甘氨酸、FeSO₄与Na₂CO₃反应生成Fe(H₂NCH₂COO)₂,同时生成Na₂SO₄、CO₂和H₂O。
(3)Fe²⁺可提供空轨道,—NH₂中的N原子和—COO⁻中的O原子含有孤电子对,可形成配位键,2个H₂NCH₂COO⁻可与Fe²⁺形成2个五元环,结构简式为 或
或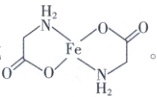
(4)甘氨酸亚铁难溶于乙醇,加入乙醇可使其析出。
(5)Fe²⁺在碱性条件下易生成Fe(OH)₂,控制pH≈5.0可提高产品产率和纯度。
(6)对比图乙中两种物质的总铁保留率,甘氨酸亚铁保留率更高,结合已知③螯合效应提高配合物的化学稳定性可知甘氨酸亚铁因螯合效应,稳定性强于硫酸亚铁,含有的Fe²⁺不易被氧化,也不易水解。
(7)n(H₂NCH₂COOH)=$\frac{15.0g}{75g·mol⁻¹}$= 0.2mol,n(FeSO₄)=n(FeSO₄·7H₂O)=$\frac{30.0g}{278g·mol⁻¹}$≈0.1079mol,FeSO₄~2H₂NCH₂COOH~Fe(H₂NCH₂COO)₂,则H₂NCH₂COOH少量,理论上H₂NCH₂COOH全部转化为Fe(H₂NCH₂COO)₂,理论上生成Fe(H₂NCH₂COO)₂的质量为$\frac{0.2mol×204g·mol⁻¹}{2}$= 20.4g,Fe(H₂NCH₂COO)₂的产率=$\frac{15.9g}{20.4g}$×100%≈77.9%。
17.(除标注外,每空2分,共14分)
(1)恒压滴液漏斗
(2)排出装置内的空气,防止Fe²⁺被氧化(1分)
2H₂NCH₂COOH + FeSO₄ + Na₂CO₃ = Fe(H₂NCH₂COO)₂ + Na₂SO₄ + H₂O + CO₂↑
(3)

(4)乙醇(1分)
(5)溶液pH过高,会生成Fe(OH)₂沉淀,导致产品纯度下降
(6)甘氨酸亚铁因螯合效应更稳定,Fe²⁺不易被氧化,也不易水解
(7)77.9%
必考题型化学实验综合,涉及实验仪器的识别、实验操作目的、化学方程式书写、结构简式书写、实验条件控制、产率计算等
装置解读:

[深度解析]
(1)仪器A为恒压滴液漏斗,可平衡漏斗内外压强,使液体顺利滴下。
(2)甘氨酸、FeSO₄与Na₂CO₃反应生成Fe(H₂NCH₂COO)₂,同时生成Na₂SO₄、CO₂和H₂O。
(3)Fe²⁺可提供空轨道,—NH₂中的N原子和—COO⁻中的O原子含有孤电子对,可形成配位键,2个H₂NCH₂COO⁻可与Fe²⁺形成2个五元环,结构简式为
 或
或
(4)甘氨酸亚铁难溶于乙醇,加入乙醇可使其析出。
(5)Fe²⁺在碱性条件下易生成Fe(OH)₂,控制pH≈5.0可提高产品产率和纯度。
(6)对比图乙中两种物质的总铁保留率,甘氨酸亚铁保留率更高,结合已知③螯合效应提高配合物的化学稳定性可知甘氨酸亚铁因螯合效应,稳定性强于硫酸亚铁,含有的Fe²⁺不易被氧化,也不易水解。
(7)n(H₂NCH₂COOH)=$\frac{15.0g}{75g·mol⁻¹}$= 0.2mol,n(FeSO₄)=n(FeSO₄·7H₂O)=$\frac{30.0g}{278g·mol⁻¹}$≈0.1079mol,FeSO₄~2H₂NCH₂COOH~Fe(H₂NCH₂COO)₂,则H₂NCH₂COOH少量,理论上H₂NCH₂COOH全部转化为Fe(H₂NCH₂COO)₂,理论上生成Fe(H₂NCH₂COO)₂的质量为$\frac{0.2mol×204g·mol⁻¹}{2}$= 20.4g,Fe(H₂NCH₂COO)₂的产率=$\frac{15.9g}{20.4g}$×100%≈77.9%。
18. (13 分) 乙烯年产量是衡量国家石油化工发展水平的
重要指标,乙烷制乙烯具有极高的经济效
▶
Ⅰ. 乙烷催化裂解法:
i. C₂H₆(g) ⇌ C₂H₄(g)+H₂(g) ΔH₁
(1) 已知 C₂H₆(g)、H₂(g) 和 C₂H₄(g) 的燃烧热分别是
1 560 kJ·mol⁻¹、285.8 kJ·mol⁻¹ 和 1 411.0 kJ·mol⁻¹,
则 ΔH₁ = ,该反应在 (填 “低温”
“高温” 或 “任何温度”)时能自发进行。
(2) 一定条件下,向 2 L 密闭容器中通入 4 mol 乙烷,使其发生反
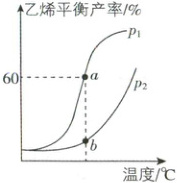
应 i ,测得乙烯平衡产率随温度、
压强的变化如图所示:
①p₁ p₂(填 “>” 或 “<”)。
②在 a 点对应的温度和压强下,反应恰好达到平衡
状态所用时间为 5 min,则 0~5 min 内的平均反应速
率 v(C₂H₆) = 。
Ⅱ. 乙烷催化氧化法:ii. 2C₂H₆(g)+O₂(g) ⇌
2C₂H₄(g)+2H₂O(g) ΔH₂<0
副反应:iii. 2C₂H₆(g)+5O₂(g) ⇌ 4CO(g)+6H₂O(g)
ΔH₃<0
iv. C₂H₄(g)+2O₂(g) ⇌ 2CO(g)+2H₂O(g) ΔH₄<0
(3) 乙烷催化裂解制乙烯时常会发生积碳反应,生成
的碳会附着在催化剂的表面,降低催化剂的活性,而
乙烷催化氧化制乙烯时很少有积碳,可能原因是
。
(4) 在恒容的密闭容器中充入 1 mol C₂H₆ 和 1 mol
O₂,初始压强为 200 kPa,在催化剂作用下发生上述
反应,测得平衡时相关数据如表所示:
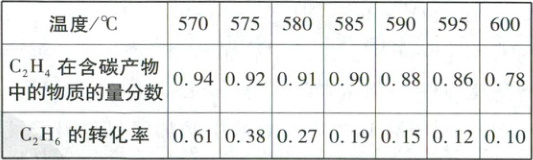
①乙烯的物质的量分数随温度升高而降低的原因是
。
②585 ℃ 条件下,平衡时 C₂H₄ 的物质的量 n(C₂H₄) =
mol。反应 ii 的标准压强平衡常数 Kₚ =
(只要求列出计算式。标准压强
平衡常数 Kₚ 定义:对于反应 A ⇌ 2B,Kₚ = (pᴮ)²/pᴬ,
其中 p = 100 kPa)。
重要指标,乙烷制乙烯具有极高的经济效
▶
Ⅰ. 乙烷催化裂解法:
i. C₂H₆(g) ⇌ C₂H₄(g)+H₂(g) ΔH₁
(1) 已知 C₂H₆(g)、H₂(g) 和 C₂H₄(g) 的燃烧热分别是
1 560 kJ·mol⁻¹、285.8 kJ·mol⁻¹ 和 1 411.0 kJ·mol⁻¹,
则 ΔH₁ = ,该反应在 (填 “低温”
“高温” 或 “任何温度”)时能自发进行。
(2) 一定条件下,向 2 L 密闭容器中通入 4 mol 乙烷,使其发生反

应 i ,测得乙烯平衡产率随温度、
压强的变化如图所示:
①p₁ p₂(填 “>” 或 “<”)。
②在 a 点对应的温度和压强下,反应恰好达到平衡
状态所用时间为 5 min,则 0~5 min 内的平均反应速
率 v(C₂H₆) = 。
Ⅱ. 乙烷催化氧化法:ii. 2C₂H₆(g)+O₂(g) ⇌
2C₂H₄(g)+2H₂O(g) ΔH₂<0
副反应:iii. 2C₂H₆(g)+5O₂(g) ⇌ 4CO(g)+6H₂O(g)
ΔH₃<0
iv. C₂H₄(g)+2O₂(g) ⇌ 2CO(g)+2H₂O(g) ΔH₄<0
(3) 乙烷催化裂解制乙烯时常会发生积碳反应,生成
的碳会附着在催化剂的表面,降低催化剂的活性,而
乙烷催化氧化制乙烯时很少有积碳,可能原因是
。
(4) 在恒容的密闭容器中充入 1 mol C₂H₆ 和 1 mol
O₂,初始压强为 200 kPa,在催化剂作用下发生上述
反应,测得平衡时相关数据如表所示:

①乙烯的物质的量分数随温度升高而降低的原因是
。
②585 ℃ 条件下,平衡时 C₂H₄ 的物质的量 n(C₂H₄) =
mol。反应 ii 的标准压强平衡常数 Kₚ =
(只要求列出计算式。标准压强
平衡常数 Kₚ 定义:对于反应 A ⇌ 2B,Kₚ = (pᴮ)²/pᴬ,
其中 p = 100 kPa)。
答案:
18.(除标注外,每空2分,共13分)
(1)+136.8kJ·mol⁻¹ 高温(1分)
(2)①<(1分) ②0.24mol·L⁻¹·min⁻¹(1分)
(3)C与O₂发生反应生成CO₂,从而使积碳减少
(4)①反应ⅱ、ⅳ均为放热反应,升高温度,反应ⅱ平衡逆向移动程度更大,导致乙烯在含碳产物中物质的量分数降低。②初始充入1molC₂H₆和1molO₂,585℃时,C₂H₆转化率α = 0.19,C₂H₄在含碳产物中物质的量分数为90%,含碳产物为C₂H₄和CO,设平衡时C₂H₄的物质的量为xmol,CO的物质的量为ymol,根据碳原子守恒得x+$\frac{1}{2}$y = α×1 = 0.19,且$\frac{x}{x + y}$= 0.9,解得y = 0.02、x = 0.18。平衡时n(C₂H₆)=(1 - 0.19)mol = 0.81mol、n(C₂H₄)= 0.18mol、n(CO)= 0.02mol,由H原子守恒得n(H₂O)=(0.19mol×6 - 0.18mol×4 - $\frac{1}{2}$×0.02mol×2)= 0.21mol,由O原子守恒得,n(O₂)=(1mol×2 - 0.02mol - 0.21mol)×$\frac{1}{2}$= 0.885mol,nₐ=n(C₂H₆)+n(O₂)+n(H₂O)+n(CO)=(0.81 + 0.885 + 0.21 + 0.02 + 0.18)mol = 2.105mol,初始气体总物质的量为2mol,压强为200kPa,平衡时pₐ=$\frac{nₐ}{2mol}$×200kPa = 210.5kPa,p_{C₂H₄}=$\frac{n(C₂H₄)}{nₐ}$×pₐ=$\frac{0.18}{2.105}$×210.5kPa = 18kPa、p_{H₂O}= 21kPa、p_{C₂H₆}= 81kPa、p_{O₂}= 88.5kPa,反应ⅱ的K_P=$\frac{(\frac{p_{C₂H₄}}{p^θ})²×(\frac{p_{H₂O}}{p^θ})²}{(\frac{p_{C₂H₆}}{p^θ})²×(\frac{p_{O₂}}{p^θ})}$=$\frac{0.18²×0.21²}{0.81²×0.885}$
必考题型化学反应原理综合,涉及盖斯定律、反应自发进行的条件、化学平衡移动、反应速率及标准压强平衡常数计算等
[深度解析]
(1)△H = 反应物的燃烧热之和 - 生成物的燃烧热之和 = - 1560kJ·mol⁻¹ - [( - 1411.0)+( - 285.8)]kJ·mol⁻¹ = + 136.8kJ·mol⁻¹。反应i为气体分子总数增大的吸热反应,即△H > 0、△S > 0,△G = △H - T△S,当△G < 0时反应可以自发进行,即在高温下反应i可自发。
(2)①反应i正向气体分子数增大,增大压强,平衡逆向移动,则其他条件相同时,压强越小,乙烯平衡产率越高,故P₁ < P₂;②根据题图可知α点对应的温度和压强下,乙烯的平衡产率为60%,C₂H₆~C₂H₄,则v(C₂H₄)=$\frac{\frac{4mol×60\%}{2L}}{5min}$= 0.24mol·L⁻¹·min⁻¹。
(3)乙烷催化氧化法中O₂可将生成的碳氧化为气体,减少积碳。
(4)①反应ⅱ为放热反应,温度升高,平衡逆向移动,减少乙烯生成,反应ⅳ也为放热反应,温度升高,平衡逆向移动,乙烯增多,但反应ⅱ平衡逆向移动程度更大,导致乙烯在含碳产物中物质的量分数降低。
(1)+136.8kJ·mol⁻¹ 高温(1分)
(2)①<(1分) ②0.24mol·L⁻¹·min⁻¹(1分)
(3)C与O₂发生反应生成CO₂,从而使积碳减少
(4)①反应ⅱ、ⅳ均为放热反应,升高温度,反应ⅱ平衡逆向移动程度更大,导致乙烯在含碳产物中物质的量分数降低。②初始充入1molC₂H₆和1molO₂,585℃时,C₂H₆转化率α = 0.19,C₂H₄在含碳产物中物质的量分数为90%,含碳产物为C₂H₄和CO,设平衡时C₂H₄的物质的量为xmol,CO的物质的量为ymol,根据碳原子守恒得x+$\frac{1}{2}$y = α×1 = 0.19,且$\frac{x}{x + y}$= 0.9,解得y = 0.02、x = 0.18。平衡时n(C₂H₆)=(1 - 0.19)mol = 0.81mol、n(C₂H₄)= 0.18mol、n(CO)= 0.02mol,由H原子守恒得n(H₂O)=(0.19mol×6 - 0.18mol×4 - $\frac{1}{2}$×0.02mol×2)= 0.21mol,由O原子守恒得,n(O₂)=(1mol×2 - 0.02mol - 0.21mol)×$\frac{1}{2}$= 0.885mol,nₐ=n(C₂H₆)+n(O₂)+n(H₂O)+n(CO)=(0.81 + 0.885 + 0.21 + 0.02 + 0.18)mol = 2.105mol,初始气体总物质的量为2mol,压强为200kPa,平衡时pₐ=$\frac{nₐ}{2mol}$×200kPa = 210.5kPa,p_{C₂H₄}=$\frac{n(C₂H₄)}{nₐ}$×pₐ=$\frac{0.18}{2.105}$×210.5kPa = 18kPa、p_{H₂O}= 21kPa、p_{C₂H₆}= 81kPa、p_{O₂}= 88.5kPa,反应ⅱ的K_P=$\frac{(\frac{p_{C₂H₄}}{p^θ})²×(\frac{p_{H₂O}}{p^θ})²}{(\frac{p_{C₂H₆}}{p^θ})²×(\frac{p_{O₂}}{p^θ})}$=$\frac{0.18²×0.21²}{0.81²×0.885}$
必考题型化学反应原理综合,涉及盖斯定律、反应自发进行的条件、化学平衡移动、反应速率及标准压强平衡常数计算等
[深度解析]
(1)△H = 反应物的燃烧热之和 - 生成物的燃烧热之和 = - 1560kJ·mol⁻¹ - [( - 1411.0)+( - 285.8)]kJ·mol⁻¹ = + 136.8kJ·mol⁻¹。反应i为气体分子总数增大的吸热反应,即△H > 0、△S > 0,△G = △H - T△S,当△G < 0时反应可以自发进行,即在高温下反应i可自发。
(2)①反应i正向气体分子数增大,增大压强,平衡逆向移动,则其他条件相同时,压强越小,乙烯平衡产率越高,故P₁ < P₂;②根据题图可知α点对应的温度和压强下,乙烯的平衡产率为60%,C₂H₆~C₂H₄,则v(C₂H₄)=$\frac{\frac{4mol×60\%}{2L}}{5min}$= 0.24mol·L⁻¹·min⁻¹。
(3)乙烷催化氧化法中O₂可将生成的碳氧化为气体,减少积碳。
(4)①反应ⅱ为放热反应,温度升高,平衡逆向移动,减少乙烯生成,反应ⅳ也为放热反应,温度升高,平衡逆向移动,乙烯增多,但反应ⅱ平衡逆向移动程度更大,导致乙烯在含碳产物中物质的量分数降低。
查看更多完整答案,请扫码查看


