2026年理想树试题攻略高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年理想树试题攻略高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10. 某学习小组在实验室从海带中提取碘,设计实验流
程如下:
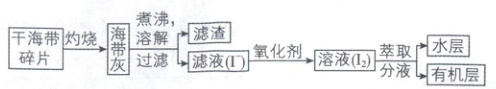
下列说法正确的是
A.将干海带碎片放入蒸发皿中进行灼烧,得到海带灰
B.过滤操作主要是除去海带灰中难溶于水的固体有
机物
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因 I₂ 易升华,难以通过蒸馏法彻底分离出有机溶
液中的 I₂
程如下:

下列说法正确的是
A.将干海带碎片放入蒸发皿中进行灼烧,得到海带灰
B.过滤操作主要是除去海带灰中难溶于水的固体有
机物
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因 I₂ 易升华,难以通过蒸馏法彻底分离出有机溶
液中的 I₂
答案:
10. D 经典题型实验室海带提碘的流程分析,涉及灼烧、过滤、萃取、升华等分离操作
[深度解析]灼烧海带应在坩埚中进行,蒸发皿常用于蒸发溶液,A错误;灼烧的目的之一就是将海带中的有机物除去,有机物燃烧的产物主要为CO₂和H₂O,过滤的主要目的是除去海带灰中的难溶无机物,B错误;酒精与水以任意比混溶,不可用作萃取剂,C错误;可通过蒸馏将有机层中的有机溶剂蒸出,但I₂易升华,故无法彻底分离,D正确。
[深度解析]灼烧海带应在坩埚中进行,蒸发皿常用于蒸发溶液,A错误;灼烧的目的之一就是将海带中的有机物除去,有机物燃烧的产物主要为CO₂和H₂O,过滤的主要目的是除去海带灰中的难溶无机物,B错误;酒精与水以任意比混溶,不可用作萃取剂,C错误;可通过蒸馏将有机层中的有机溶剂蒸出,但I₂易升华,故无法彻底分离,D正确。
11. 在银的催化作用下,乙烯和氧气可以直接发生氧化
反应生成环氧乙烷(EO)和乙醛(AA),反应过程如
图所示。ads 代表吸附态,下列说法错误的是
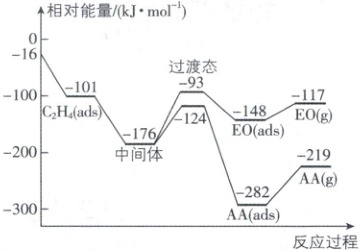
A.该反应中,乙烯的吸附过程要释放能量
B.中间体转化为 EO(ads) 的活化能为 83 kJ·mol⁻¹
C.生成两种产物的过程均有 π 键断裂和 σ 键生成
D.反应达平衡时,升高温度,乙烯的转化率增大
反应生成环氧乙烷(EO)和乙醛(AA),反应过程如
图所示。ads 代表吸附态,下列说法错误的是

A.该反应中,乙烯的吸附过程要释放能量
B.中间体转化为 EO(ads) 的活化能为 83 kJ·mol⁻¹
C.生成两种产物的过程均有 π 键断裂和 σ 键生成
D.反应达平衡时,升高温度,乙烯的转化率增大
答案:
11. D 热门考点反应机理分析,涉及能量变化、活化能、化学键变化、平衡移动
要点图解: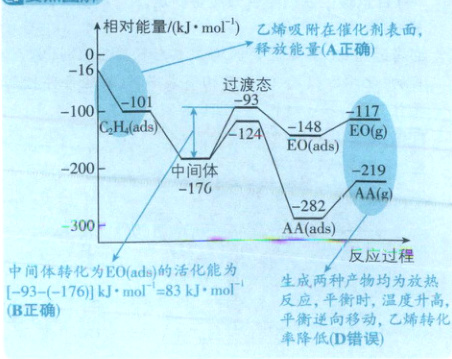
拆招式超详解
[深度解析]生成两种产物时,乙烯中的碳碳双键的π键均会发生断裂,生成环氧乙烷会形成C—O键(σ键),生成乙醛会形成C=O键(1个σ键、1个π键)及C—H键(σ键),C正确。
11. D 热门考点反应机理分析,涉及能量变化、活化能、化学键变化、平衡移动
要点图解:

拆招式超详解
[深度解析]生成两种产物时,乙烯中的碳碳双键的π键均会发生断裂,生成环氧乙烷会形成C—O键(σ键),生成乙醛会形成C=O键(1个σ键、1个π键)及C—H键(σ键),C正确。
12. 如图是由 Pb、S 两种元素组成的结晶型化合物的晶
胞结构(晶胞参数 α=β=γ=90° 且 a = b ≠ c)。
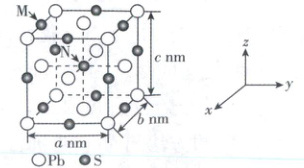
设$N_{A}$为阿伏加德罗常数的值,下列说法正确的是
A. 该物质的化学式为$PbS_{2}$
B. 该晶体密度为$\frac {956}{N_{A}ac×10^{-21}}g· cm^{-3}$
C. M 的分数坐标为 (0, 1/2,1)
D. M、N 处 S 的核间距为 √2/2 a nm
胞结构(晶胞参数 α=β=γ=90° 且 a = b ≠ c)。

设$N_{A}$为阿伏加德罗常数的值,下列说法正确的是
A. 该物质的化学式为$PbS_{2}$
B. 该晶体密度为$\frac {956}{N_{A}ac×10^{-21}}g· cm^{-3}$
C. M 的分数坐标为 (0, 1/2,1)
D. M、N 处 S 的核间距为 √2/2 a nm
答案:
12. B 常规考点晶胞结构分析与计算,涉及均摊法、晶体密度、原子分数坐标、微粒间距离
要点图解: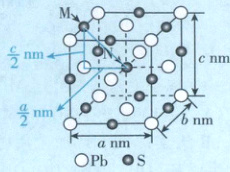
[深度解析]Pb位于晶胞的顶点和面心,有8×$\frac{1}{8}$+6×$\frac{1}{2}$= 4个,S位于晶胞的体心和棱心,有12×$\frac{1}{4}$+1 = 4个,所以该物质的化学式为PbS,A错误;该晶胞中含4个PbS,质量为$\frac{4×(207 + 32)}{N_A}$g,体积为abcnm³ = a²c×10⁻²¹cm³,所以该晶体密度ρ=$\frac{m}{V}$=$\frac{\frac{4×(207 + 32)}{N_A}g}{a²c×10⁻²¹cm³}$=$\frac{956}{N_A×a²c×10⁻²¹}$g·cm⁻³,B正确;由坐标系可知,M的分数坐标为($\frac{1}{2}$,0,1),C错误;M、N处S的核间距=$\sqrt{(\frac{a}{2})² + (\frac{c}{2})²}$nm=$\frac{\sqrt{a² + c²}}{2}$nm,D错误。
12. B 常规考点晶胞结构分析与计算,涉及均摊法、晶体密度、原子分数坐标、微粒间距离
要点图解:

[深度解析]Pb位于晶胞的顶点和面心,有8×$\frac{1}{8}$+6×$\frac{1}{2}$= 4个,S位于晶胞的体心和棱心,有12×$\frac{1}{4}$+1 = 4个,所以该物质的化学式为PbS,A错误;该晶胞中含4个PbS,质量为$\frac{4×(207 + 32)}{N_A}$g,体积为abcnm³ = a²c×10⁻²¹cm³,所以该晶体密度ρ=$\frac{m}{V}$=$\frac{\frac{4×(207 + 32)}{N_A}g}{a²c×10⁻²¹cm³}$=$\frac{956}{N_A×a²c×10⁻²¹}$g·cm⁻³,B正确;由坐标系可知,M的分数坐标为($\frac{1}{2}$,0,1),C错误;M、N处S的核间距=$\sqrt{(\frac{a}{2})² + (\frac{c}{2})²}$nm=$\frac{\sqrt{a² + c²}}{2}$nm,D错误。
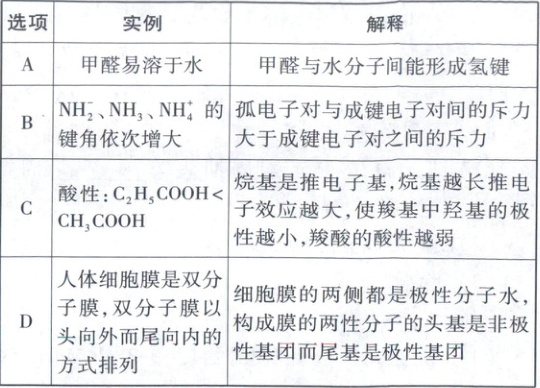
13. 下列对有关物质结构或性质的解释不合理的是

答案:
13. D 常规考点物质结构与性质,涉及氢键、键角比较、酸性比较、分子极性
[深度解析]甲醛中O原子可与水分子中的H原子形成氢键,所以甲醛易溶于水,A正确;NH₂、NH、NH⁺中N原子均为sp³杂化,NH₂含2个孤电子对,NH含1个孤电子对,NH⁺中无孤电子对,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力,所以NH₂的键角最小,NH⁺的键角最大,B正确;烷基是推电子基,烷基越长推电子效应越强,使得羧基中O—H键的极性减小,而不容易给出H⁺,酸性减弱,C正确;细胞膜为磷脂双分子层,由亲水的极性头部(含磷酸基团)和疏水的非极性尾部(脂肪酸链)构成,D错误。
教材盲点:细胞和细胞器的双分子膜
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端强极性,另一端弱极性)组装而成的,双分子膜如图所示。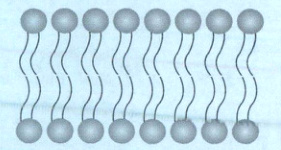
为什么双分子膜以头向外而尾向内的方式排列?这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
13. D 常规考点物质结构与性质,涉及氢键、键角比较、酸性比较、分子极性
[深度解析]甲醛中O原子可与水分子中的H原子形成氢键,所以甲醛易溶于水,A正确;NH₂、NH、NH⁺中N原子均为sp³杂化,NH₂含2个孤电子对,NH含1个孤电子对,NH⁺中无孤电子对,孤电子对与成键电子对间的斥力大于成键电子对之间的斥力,所以NH₂的键角最小,NH⁺的键角最大,B正确;烷基是推电子基,烷基越长推电子效应越强,使得羧基中O—H键的极性减小,而不容易给出H⁺,酸性减弱,C正确;细胞膜为磷脂双分子层,由亲水的极性头部(含磷酸基团)和疏水的非极性尾部(脂肪酸链)构成,D错误。
教材盲点:细胞和细胞器的双分子膜
人体细胞和细胞器的膜是双分子膜,双分子膜是由大量两性分子(一端强极性,另一端弱极性)组装而成的,双分子膜如图所示。

为什么双分子膜以头向外而尾向内的方式排列?这是由于细胞膜的两侧都是水溶液,水是极性分子,而构成膜的两性分子的头基是极性基团而尾基是非极性基团。
14. 一种主要成分是 FeTiO₃ 的钛铁矿含少量 FeO、
Al₂O₃、SiO₂ 杂质,以该钛铁矿为原料生产 TiO₂ 的工
艺流程如图所示(部分步骤、条件和产物已省略)。
已知:TiOSO₄ 极易水解生成 TiO(OH)₂ 沉淀。下列
说法正确的是
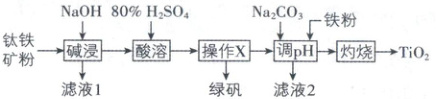
A.滤液 1 中阴离子主要是 SiO₃²⁻ 和 OH⁻
B.“操作 X” 为蒸发浓缩、冷却结晶
C.“调 pH” 加入铁粉可以防止 Fe²⁺ 被氧化
D.“灼烧” 时必须隔绝空气
Al₂O₃、SiO₂ 杂质,以该钛铁矿为原料生产 TiO₂ 的工
艺流程如图所示(部分步骤、条件和产物已省略)。
已知:TiOSO₄ 极易水解生成 TiO(OH)₂ 沉淀。下列
说法正确的是

A.滤液 1 中阴离子主要是 SiO₃²⁻ 和 OH⁻
B.“操作 X” 为蒸发浓缩、冷却结晶
C.“调 pH” 加入铁粉可以防止 Fe²⁺ 被氧化
D.“灼烧” 时必须隔绝空气
答案:
14. C 常规考点微工艺流程,涉及流程分析、分离提纯、试剂作用等
流程分析: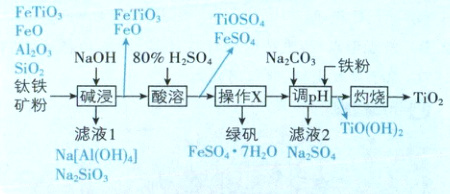
[深度解析]滤液1中阴离子主要是SiO₃²⁻、[Al(OH)₄]⁻和OH⁻,A错误;“操作X”的目的是将FeSO₄分离,为蒸发浓缩、冷却结晶、过滤,B错误;“调pH”加入铁粉可以防止残留的Fe²⁺被氧化生成Fe(OH)₃而使TiO(OH)₂不纯,C正确;“灼烧”时,Ti已为最高价,无需隔绝空气,D错误。
14. C 常规考点微工艺流程,涉及流程分析、分离提纯、试剂作用等
流程分析:

[深度解析]滤液1中阴离子主要是SiO₃²⁻、[Al(OH)₄]⁻和OH⁻,A错误;“操作X”的目的是将FeSO₄分离,为蒸发浓缩、冷却结晶、过滤,B错误;“调pH”加入铁粉可以防止残留的Fe²⁺被氧化生成Fe(OH)₃而使TiO(OH)₂不纯,C正确;“灼烧”时,Ti已为最高价,无需隔绝空气,D错误。
15. T₁ 温度时,在容积为 2 L 的恒容密闭容器中发生
反应 2NO+O₂ ⇌ 2NO₂ ΔH<0,实验测得:v₊ =
v₋消耗(NO) = 2v₋消耗(O₂) = k₊c²(NO)·c(O₂),v₋ =
v₋消耗(NO₂) = k₋c²(NO₂),k₊、k₋ 为速率常数,受温度
影响。容器中各反应物和生成物的物质的量随时间
变化如图所示。下列说法正确的是
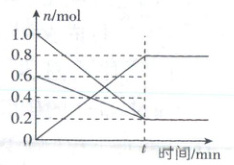
A.k₊、k₋ 不变能说明该反应
达到平衡状态
B.反应的化学平衡常数 K= k₋/k₊
C.温度为 T₁ 时的化学平衡常数 K= 160
D.若将容器的温度变为 T₂ 时 k₊ = k₋,则 T₂<T₁
反应 2NO+O₂ ⇌ 2NO₂ ΔH<0,实验测得:v₊ =
v₋消耗(NO) = 2v₋消耗(O₂) = k₊c²(NO)·c(O₂),v₋ =
v₋消耗(NO₂) = k₋c²(NO₂),k₊、k₋ 为速率常数,受温度
影响。容器中各反应物和生成物的物质的量随时间
变化如图所示。下列说法正确的是

A.k₊、k₋ 不变能说明该反应
达到平衡状态
B.反应的化学平衡常数 K= k₋/k₊
C.温度为 T₁ 时的化学平衡常数 K= 160
D.若将容器的温度变为 T₂ 时 k₊ = k₋,则 T₂<T₁
答案:
15. C 重难考点化学平衡,涉及速率常数、平衡判定、平衡常数计算、平衡移动
要点图解:反应过程中物质的量变化量之比等于化学计量数之比,可得曲线对应物质: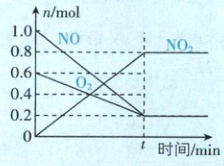
[深度解析]速率常数只与温度有关,温度不变,速率常数不变,不能作为判断平衡的标志,A错误;当vₐ = vₑ时达到化学平衡状态,可得kₐc²(NO)·c(O₂)=kₑc²(NO₂),可得K=$\frac{c²(NO₂)}{c²(NO)·c(O₂)}$=$\frac{kₐ}{kₑ}$,B错误;平衡时,容器内c(NO)=$\frac{0.2}{2}$mol·L⁻¹ = 0.1mol·L⁻¹,c(O₂)=$\frac{0.8}{2}$mol·L⁻¹ = 0.4mol·L⁻¹,可得K=$\frac{0.4²}{0.1²×0.1}$= 160,C正确;该反应为放热反应,温度升高,平衡逆移,平衡常数减小,T₂时kₐ = kₑ,即K = 1 < 160,可得T₂ > T₁,D错误。
15. C 重难考点化学平衡,涉及速率常数、平衡判定、平衡常数计算、平衡移动
要点图解:反应过程中物质的量变化量之比等于化学计量数之比,可得曲线对应物质:

[深度解析]速率常数只与温度有关,温度不变,速率常数不变,不能作为判断平衡的标志,A错误;当vₐ = vₑ时达到化学平衡状态,可得kₐc²(NO)·c(O₂)=kₑc²(NO₂),可得K=$\frac{c²(NO₂)}{c²(NO)·c(O₂)}$=$\frac{kₐ}{kₑ}$,B错误;平衡时,容器内c(NO)=$\frac{0.2}{2}$mol·L⁻¹ = 0.1mol·L⁻¹,c(O₂)=$\frac{0.8}{2}$mol·L⁻¹ = 0.4mol·L⁻¹,可得K=$\frac{0.4²}{0.1²×0.1}$= 160,C正确;该反应为放热反应,温度升高,平衡逆移,平衡常数减小,T₂时kₐ = kₑ,即K = 1 < 160,可得T₂ > T₁,D错误。
查看更多完整答案,请扫码查看


