2025年练客单元期末大练考九年级化学全一册通用版安徽专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年练客单元期末大练考九年级化学全一册通用版安徽专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第63页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
1. 从某废旧电子产品中可以提炼贵重金属,并得到硫酸铜溶液,其工艺流程如图所示,回答下列问题。
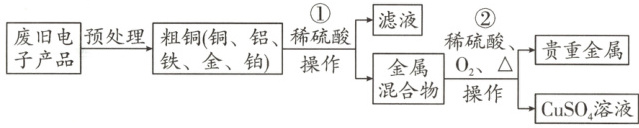
(1) 为了使废旧电子产品中的金属在步骤①充分反应并使其得到充分回收,预处理的办法是
(2) 实验室中进行图中的“操作”要用到玻璃棒,其作用是
(3) 写出所得贵重金属中任意一种成分的化学式
(4) 写出步骤①中发生反应的化学方程式

(1) 为了使废旧电子产品中的金属在步骤①充分反应并使其得到充分回收,预处理的办法是
将废旧电子产品粉碎
。(2) 实验室中进行图中的“操作”要用到玻璃棒,其作用是
引流
。(3) 写出所得贵重金属中任意一种成分的化学式
Au(或Pt)
。(4) 写出步骤①中发生反应的化学方程式
Fe + H₂SO₄ ══ FeSO₄ + H₂↑[或2Al + 3H₂SO₄ ══ Al₂(SO₄)₃ + 3H₂↑]
(写出一种即可),该反应的类型是置换反应
。
答案:
1.
(1)将废旧电子产品粉碎
(2)引流
(3)Au(或Pt)
(4)Fe + H₂SO₄ ══ FeSO₄ + H₂↑[或2Al + 3H₂SO₄ ══ Al₂(SO₄)₃ + 3H₂↑] 置换反应
(1)将废旧电子产品粉碎
(2)引流
(3)Au(或Pt)
(4)Fe + H₂SO₄ ══ FeSO₄ + H₂↑[或2Al + 3H₂SO₄ ══ Al₂(SO₄)₃ + 3H₂↑] 置换反应
2. 以黄铜废料为原料制备石绿$[Cu_{2}(OH)_{2}CO_{3}]$的一种流程如下:
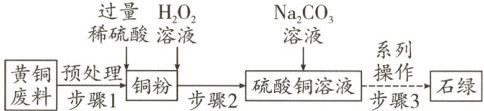
【查阅资料】①黄铜废料中含铜$84\%~86\%$,含锌$14\%~16\%$,杂质总量$\leq 0.3\%$。②$59^{\circ}C$时,向$5\%$的碳酸钠溶液中加入$8\%$的硫酸铜溶液,可制得产率较高的石绿固体。
(1) 黄铜属于金属材料中的
(2) “预处理”时使用稀硫酸酸浸的目的是
(3) 写出铜与稀硫酸、过氧化氢溶液反应生成硫酸铜和水的化学方程式
(4) “系列操作”包括过滤、洗涤、干燥等,在实验室过滤时用到的玻璃仪器有烧杯、漏斗、
(5) 本实验中,提高石绿产率可采取的措施有

【查阅资料】①黄铜废料中含铜$84\%~86\%$,含锌$14\%~16\%$,杂质总量$\leq 0.3\%$。②$59^{\circ}C$时,向$5\%$的碳酸钠溶液中加入$8\%$的硫酸铜溶液,可制得产率较高的石绿固体。
(1) 黄铜属于金属材料中的
合金
(填“合金”或“纯金属”)。(2) “预处理”时使用稀硫酸酸浸的目的是
除锌
。(3) 写出铜与稀硫酸、过氧化氢溶液反应生成硫酸铜和水的化学方程式
Cu + H₂SO₄ + H₂O₂ ══ CuSO₄ + 2H₂O
。(4) “系列操作”包括过滤、洗涤、干燥等,在实验室过滤时用到的玻璃仪器有烧杯、漏斗、
玻璃棒
。(5) 本实验中,提高石绿产率可采取的措施有
控制温度(或选择合适浓度的碳酸钠溶液和硫酸铜溶液,合理即可)
(写出一条即可)。
答案:
2.
(1)合金
(2)除锌
(3)Cu + H₂SO₄ + H₂O₂ ══ CuSO₄ + 2H₂O
(4)玻璃棒
(5)控制温度(或选择合适浓度的碳酸钠溶液和硫酸铜溶液,合理即可)
(1)合金
(2)除锌
(3)Cu + H₂SO₄ + H₂O₂ ══ CuSO₄ + 2H₂O
(4)玻璃棒
(5)控制温度(或选择合适浓度的碳酸钠溶液和硫酸铜溶液,合理即可)
3. “太阳能光伏发电”能有效推进“碳中和”,发展“低碳经济”,其关键的材料是高纯硅。以下是高纯硅的简易生产流程。
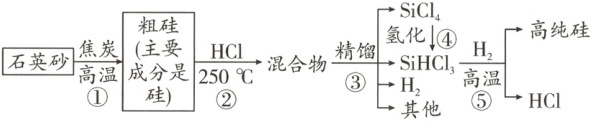
(1) 地壳中含有大量的硅元素,它的含量仅次于
(2) 标出四氯化硅$(SiCl_{4})$中硅元素的化合价
(3) 石英砂的主要成分是$SiO_{2}$,步骤①在制取粗硅过程中,除生成硅外还生成一种有毒气体,写出该反应的化学方程式
(4) 为了达到资源综合利用的目的,生产流程中的氢气和
(5) 步骤⑤在$H_{2}$还原$SiHCl_{3}$过程中若混入$O_{2}$,可能引起的后果有

(1) 地壳中含有大量的硅元素,它的含量仅次于
O
(填元素符号)。(2) 标出四氯化硅$(SiCl_{4})$中硅元素的化合价
SiCl₄
。(3) 石英砂的主要成分是$SiO_{2}$,步骤①在制取粗硅过程中,除生成硅外还生成一种有毒气体,写出该反应的化学方程式
SiO₂ + 2C\stackrel{高温}{══}Si + 2CO↑
。(4) 为了达到资源综合利用的目的,生产流程中的氢气和
HCl(或氯化氢)
可循环使用。(5) 步骤⑤在$H_{2}$还原$SiHCl_{3}$过程中若混入$O_{2}$,可能引起的后果有
硅与氧气反应得不到高纯硅(或可能发生爆炸,合理即可)
(填一种即可)。
答案:
$3.(1)O (2)SiCl₄ (3)SiO₂ + 2C\stackrel{高温}{══}Si + 2CO↑ (4)HCl($或氯化氢)
(5)硅与氧气反应得不到高纯硅(或可能发生爆炸,合理即可)
(5)硅与氧气反应得不到高纯硅(或可能发生爆炸,合理即可)
查看更多完整答案,请扫码查看


