2025年练客单元期末大练考九年级化学全一册通用版安徽专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年练客单元期末大练考九年级化学全一册通用版安徽专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第39页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
14. (6分)化学是以实验为基础的科学,实验是科学探究的重要手段。
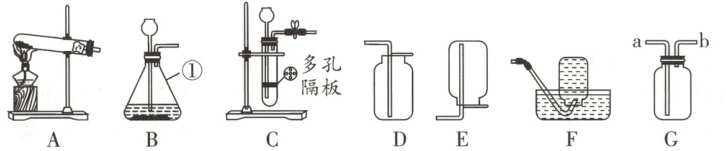
(1) 请写出图B中标号①仪器的名称:
(2) 实验室用高锰酸钾制取并收集较纯净的氧气,可选择的装置的组合是
(3) 实验室制取二氧化碳,可将装置B与装置G的 (选填“a”或“b”)连接,若将装置B改为装置C,其优点是

(1) 请写出图B中标号①仪器的名称:
锥形瓶
。(2) 实验室用高锰酸钾制取并收集较纯净的氧气,可选择的装置的组合是
$\mathrm{AF}$
,该反应的化学方程式为$\mathrm{2KMnO_4\xlongequal{\triangle}K_2MnO_4 + MnO_2 + O_2\uparrow}$
。(3) 实验室制取二氧化碳,可将装置B与装置G的 (选填“a”或“b”)连接,若将装置B改为装置C,其优点是
可以控制反应的发生和停止
。
答案:
14.
(1)锥形瓶
(2)$\mathrm{AF\ 2KMnO_4\xlongequal{\triangle}K_2MnO_4 + MnO_2 + O_2\uparrow}$
(3)a可以控制反应的发生和停止
(1)锥形瓶
(2)$\mathrm{AF\ 2KMnO_4\xlongequal{\triangle}K_2MnO_4 + MnO_2 + O_2\uparrow}$
(3)a可以控制反应的发生和停止
15. (6分)某实践小组参观本地矿泉水厂,该厂矿泉水含钙、钾等矿物质,其生产流程示意图如下。回答下列问题。
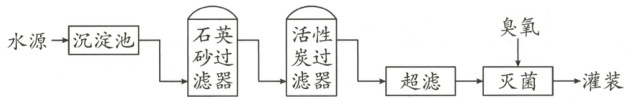
(1) 矿泉水中的钙、钾指的是 (选填“元素”或“单质”)。
(2) 活性炭具有很强的吸附性,其原因是
(3) 超滤是利用薄膜(仅允许小分子和离子通过)进行物质分离的技术。若水源中含有下列物质,
A. 难溶性大颗粒
B. 可溶性K⁺、Ca²⁺
C. 可溶性大分子和大分子团
推测该流程中“超滤”的主要作用是除去 (填字母序号)。
(4) 臭氧(O₃)可比氯气消毒快600倍,水和氧气在放电的条件下,可生成臭氧和过氧化氢,写出该反应的化学方程式
(5) 生活中,你提倡饮用白开水还是矿泉水,理由是

(1) 矿泉水中的钙、钾指的是 (选填“元素”或“单质”)。
(2) 活性炭具有很强的吸附性,其原因是
活性炭疏松多孔
。(3) 超滤是利用薄膜(仅允许小分子和离子通过)进行物质分离的技术。若水源中含有下列物质,
A. 难溶性大颗粒
B. 可溶性K⁺、Ca²⁺
C. 可溶性大分子和大分子团
推测该流程中“超滤”的主要作用是除去 (填字母序号)。
(4) 臭氧(O₃)可比氯气消毒快600倍,水和氧气在放电的条件下,可生成臭氧和过氧化氢,写出该反应的化学方程式
$\mathrm{H_2O + 2O_2\xlongequal{放电}O_3 + H_2O_2}$
。(5) 生活中,你提倡饮用白开水还是矿泉水,理由是
提倡饮用矿泉水,因为矿泉水相对于白开水更安全(或提倡饮用白开水,因为矿泉水额外包装,浪费资源,合理即可)
。
答案:
15.
(1)元素
(2)活性炭疏松多孔
(3)C
(4)$\mathrm{H_2O + 2O_2\xlongequal{放电}O_3 + H_2O_2}$
(5)提倡饮用矿泉水,因为矿泉水相对于白开水更安全(或提倡饮用白开水,因为矿泉水额外包装,浪费资源,合理即可)
(1)元素
(2)活性炭疏松多孔
(3)C
(4)$\mathrm{H_2O + 2O_2\xlongequal{放电}O_3 + H_2O_2}$
(5)提倡饮用矿泉水,因为矿泉水相对于白开水更安全(或提倡饮用白开水,因为矿泉水额外包装,浪费资源,合理即可)
16. (6分)高铁“基石”钢轨的无缝焊接是高铁平稳、安全行驶的重要保障。焊接中常用到“引火铁”(极细的铁粉),是一种准纳米材料。同学们对“引火铁”展开以下探究:
任务一:制备“引火铁”
(1) 如图1所示是用新制的四氧化三铁与纯净、干燥的氢气制备“引火铁”的装置,加热前,为检验丙装置中的空气是否排尽,从导管口M端收集一小试管气体,移近火焰,点燃,若出现 (填现象),表明空气尚未排尽。
(2) 普通铁粉不易燃烧,而“引火铁”易自燃,下列对此现象的认识中,错误的是
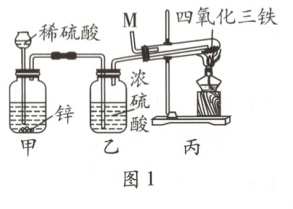
A. “引火铁”的自燃与其颗粒大小有关
B. “引火铁”的自燃是吸热反应
C. “引火铁”的自燃需要温度达到着火点
D. “引火铁”比普通铁粉更易与氧气反应
任务二:探究“引火铁”成分
同学们对反应制得的黑色固体——“引火铁”的成分展开探究:
【查阅资料】①铁粉、氧化亚铁、四氧化三铁均为黑色固体;
②四氧化三铁通常不与金属化合物溶液反应;
③氧化亚铁为黑色固体,接触到空气会立即由黑色变为红棕色。
猜想一:铁粉
猜想二:铁粉和四氧化三铁
猜想三:铁粉和氧化亚铁
猜想四:铁粉、四氧化三铁和氧化亚铁
(3)【实验探究】

【探究结论】反应后的黑色物质成分为铁粉。
任务三:探究“引火铁”的性质
(4) 同学们将制得的“引火铁”放入燃烧匙中,稍稍加热,即可剧烈燃烧,写出“引火铁”燃烧的化学方程式:
注意:若答对第(5)(6)小题奖励3分,化学总得分不超过40分。

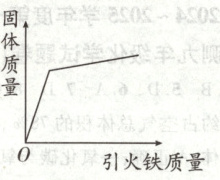
(5) 为了进一步探究“引火铁”的性质”,同学们将制备的“引火铁”加入盛有一定量AgNO₃溶液的烧杯中充分反应。请在图2中绘制出整个实验过程中烧杯内固体质量的变化趋势。
(6) 同学们将2.8 g混有铝粉的“引火铁”与足量的稀盐酸反应,若生成氢气的质量为m,则m的取值范围是
任务一:制备“引火铁”
(1) 如图1所示是用新制的四氧化三铁与纯净、干燥的氢气制备“引火铁”的装置,加热前,为检验丙装置中的空气是否排尽,从导管口M端收集一小试管气体,移近火焰,点燃,若出现 (填现象),表明空气尚未排尽。
(2) 普通铁粉不易燃烧,而“引火铁”易自燃,下列对此现象的认识中,错误的是
B
。
A. “引火铁”的自燃与其颗粒大小有关
B. “引火铁”的自燃是吸热反应
C. “引火铁”的自燃需要温度达到着火点
D. “引火铁”比普通铁粉更易与氧气反应
任务二:探究“引火铁”成分
同学们对反应制得的黑色固体——“引火铁”的成分展开探究:
【查阅资料】①铁粉、氧化亚铁、四氧化三铁均为黑色固体;
②四氧化三铁通常不与金属化合物溶液反应;
③氧化亚铁为黑色固体,接触到空气会立即由黑色变为红棕色。
猜想一:铁粉
猜想二:铁粉和四氧化三铁
猜想三:铁粉和氧化亚铁
猜想四:铁粉、四氧化三铁和氧化亚铁
(3)【实验探究】

【探究结论】反应后的黑色物质成分为铁粉。
任务三:探究“引火铁”的性质
(4) 同学们将制得的“引火铁”放入燃烧匙中,稍稍加热,即可剧烈燃烧,写出“引火铁”燃烧的化学方程式:
$\mathrm{3Fe + 2O_2\xlongequal{点燃}Fe_3O_4}$
。注意:若答对第(5)(6)小题奖励3分,化学总得分不超过40分。

(5) 为了进一步探究“引火铁”的性质”,同学们将制备的“引火铁”加入盛有一定量AgNO₃溶液的烧杯中充分反应。请在图2中绘制出整个实验过程中烧杯内固体质量的变化趋势。
(6) 同学们将2.8 g混有铝粉的“引火铁”与足量的稀盐酸反应,若生成氢气的质量为m,则m的取值范围是
$0.1\ \mathrm{g}<m<0.3\ \mathrm{g}$
(计算结果保留一位小数)。
答案:
16.
(1)尖锐的爆鸣声
(2)B
(3)$\mathrm{FeO}$黑色固体完全溶解,且有红色固体生成,溶液由蓝色变成浅绿色
(4)$\mathrm{3Fe + 2O_2\xlongequal{点燃}Fe_3O_4}$
(5)
(6)$0.1\ \mathrm{g}<m<0.3\ \mathrm{g}$
[解析]
(6)$2.8\ \mathrm{g}$混有铝粉的“引火铁”与足量的稀盐酸反应,若$2.8\ \mathrm{g}$全部是铝,设生成氢气的质量为$x$,
$\mathrm{2Al + 6HCl\xlongequal{}2AlCl_3 + 3H_2\uparrow}$
$54$ $6$
$2.8\ \mathrm{g}$ $x$
$\frac{54}{6}=\frac{2.8\ \mathrm{g}}{x}$ $x\approx0.3\ \mathrm{g}$
若$2.8\ \mathrm{g}$全部是铁,设生成氢气的质量为$y$,
$\mathrm{Fe + 2HCl\xlongequal{}FeCl_2 + H_2\uparrow}$
$56$ $2$
$2.8\ \mathrm{g}$ $y$
$\frac{56}{2}=\frac{2.8\ \mathrm{g}}{y}$ $y = 0.1\ \mathrm{g}$
则若生成氢气的质量为$m$,则$m$的取值范围是$0.1\ \mathrm{g}<m<0.3\ \mathrm{g}$。
16.
(1)尖锐的爆鸣声
(2)B
(3)$\mathrm{FeO}$黑色固体完全溶解,且有红色固体生成,溶液由蓝色变成浅绿色
(4)$\mathrm{3Fe + 2O_2\xlongequal{点燃}Fe_3O_4}$
(5)

(6)$0.1\ \mathrm{g}<m<0.3\ \mathrm{g}$
[解析]
(6)$2.8\ \mathrm{g}$混有铝粉的“引火铁”与足量的稀盐酸反应,若$2.8\ \mathrm{g}$全部是铝,设生成氢气的质量为$x$,
$\mathrm{2Al + 6HCl\xlongequal{}2AlCl_3 + 3H_2\uparrow}$
$54$ $6$
$2.8\ \mathrm{g}$ $x$
$\frac{54}{6}=\frac{2.8\ \mathrm{g}}{x}$ $x\approx0.3\ \mathrm{g}$
若$2.8\ \mathrm{g}$全部是铁,设生成氢气的质量为$y$,
$\mathrm{Fe + 2HCl\xlongequal{}FeCl_2 + H_2\uparrow}$
$56$ $2$
$2.8\ \mathrm{g}$ $y$
$\frac{56}{2}=\frac{2.8\ \mathrm{g}}{y}$ $y = 0.1\ \mathrm{g}$
则若生成氢气的质量为$m$,则$m$的取值范围是$0.1\ \mathrm{g}<m<0.3\ \mathrm{g}$。
查看更多完整答案,请扫码查看


