第98页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
7. [2025·苏州期末节选] ${CO_{2}}$过量排放会产生环境问题,一方面可通过减少${CO_{2}}$排放,另一方面可运用科学方法捕集${CO_{2}}$,实现${CO_{2}}$的循环利用。
Ⅰ. 碳循环
(1)${CO_{2}}$是自然界碳循环的重要组成部分,海水吸收是减少大气中${CO_{2}}$的重要途径,该反应的化学方程式为
Ⅱ. 碳捕集
(2)在较低温度下,用氨水(${NH_{3}\cdot H_{2}O}$)捕集${CO_{2}}$生成的{NH_{4}HCO_{3}}可作肥料。由于氨水具有强挥发性,挥发出的${NH_{3}}会与{CO_{2}}$发生反应,生成${NH_{2}COONH_{4}}$。
①写出${NH_{3}}与{CO_{2}}$反应的化学方程式:
②氨水法捕集${CO_{2}}$生成{NH_{4}HCO_{3}}时需要在较低温度下进行的原因是
Ⅲ. 碳利用
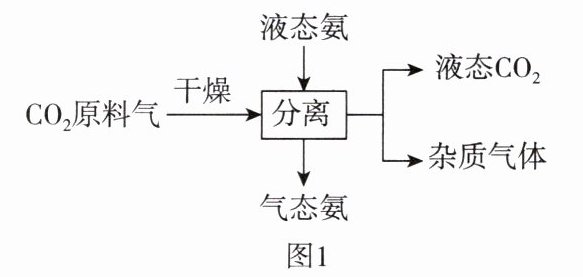
(3)工业上提纯${CO_{2}}$的主要流程如图1所示,使用液态氨“分离”提纯${CO_{2}}$的原理是
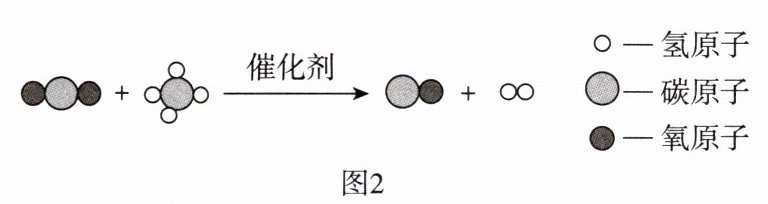
(4)${CO_{2}}$和{CH_{4}}两种温室气体在催化剂作用下能转化为合成气,反应的微观示意图如图2所示,该反应的化学方程式为
(5)${CO_{2}}$催化加氢制甲醇(${CH_{3}OH}$),反应的化学方程式为${CO_{2} + 3H_{2}\xlongequal{一定条件}CH_{3}OH + H_{2}O}$,其中$80\%的{CO_{2}}能转化为{CH_{3}OH}$,计算$44\ t\ {CO_{2}}$理论上可制得甲醇的质量。(写出计算过程)
解:根据题目可知,44 t ${CO_2}$中能转化为甲醇的${CO_2}$的质量为44 t×80%=35.2 t,设理论上可制得甲醇的质量为x。
${CO_2 + 3H_2 \xlongequal{一定条件} CH_3OH + H_2O}$
44 32
35.2 t x
$\frac{32}{44}=\frac{x}{35.2\ t}$
$x=25.6$ t
答:44 t ${CO_2}$理论上可制得甲醇的质量为25.6 t。
Ⅰ. 碳循环
(1)${CO_{2}}$是自然界碳循环的重要组成部分,海水吸收是减少大气中${CO_{2}}$的重要途径,该反应的化学方程式为
${CO_2 + H_2O = H_2CO_3}$
。Ⅱ. 碳捕集
(2)在较低温度下,用氨水(${NH_{3}\cdot H_{2}O}$)捕集${CO_{2}}$生成的{NH_{4}HCO_{3}}可作肥料。由于氨水具有强挥发性,挥发出的${NH_{3}}会与{CO_{2}}$发生反应,生成${NH_{2}COONH_{4}}$。
①写出${NH_{3}}与{CO_{2}}$反应的化学方程式:
${2NH_3 + CO_2 = NH_4COONH_4}$
。②氨水法捕集${CO_{2}}$生成{NH_{4}HCO_{3}}时需要在较低温度下进行的原因是
氨水具有强挥发性,温度较高时,氨水挥发加快,不利于生成${NH_4HCO_3}$
。Ⅲ. 碳利用
(3)工业上提纯${CO_{2}}$的主要流程如图1所示,使用液态氨“分离”提纯${CO_{2}}$的原理是
液态氨能吸收${CO_2}$原料气中的杂质气体,从而实现${CO_2}$与杂质气体的分离
。

(4)${CO_{2}}$和{CH_{4}}两种温室气体在催化剂作用下能转化为合成气,反应的微观示意图如图2所示,该反应的化学方程式为
${CO_2 + CH_4 \xlongequal{催化剂} 2CO + 2H_2}$
。(5)${CO_{2}}$催化加氢制甲醇(${CH_{3}OH}$),反应的化学方程式为${CO_{2} + 3H_{2}\xlongequal{一定条件}CH_{3}OH + H_{2}O}$,其中$80\%的{CO_{2}}能转化为{CH_{3}OH}$,计算$44\ t\ {CO_{2}}$理论上可制得甲醇的质量。(写出计算过程)
解:根据题目可知,44 t ${CO_2}$中能转化为甲醇的${CO_2}$的质量为44 t×80%=35.2 t,设理论上可制得甲醇的质量为x。
${CO_2 + 3H_2 \xlongequal{一定条件} CH_3OH + H_2O}$
44 32
35.2 t x
$\frac{32}{44}=\frac{x}{35.2\ t}$
$x=25.6$ t
答:44 t ${CO_2}$理论上可制得甲醇的质量为25.6 t。
答案:
(1)${CO_2 + H_2O = H_2CO_3}$
(2)①${2NH_3 + CO_2 = NH_4COONH_4}$②氨水具有强挥发性,温度较高时,氨水挥发加快,不利于生成${NH_4HCO_3}$
(3)液态氨能吸收${CO_2}$原料气中的杂质气体,从而实现${CO_2}$与杂质气体的分离
(4)${CO_2 + CH_4 \xlongequal{催化剂} 2CO + 2H_2}$
(5)解:根据题目可知,44 t ${CO_2}$中能转化为甲醇的${CO_2}$的质量为44 t×80%=35.2 t,设理论上可制得甲醇的质量为x。${CO_2 + 3H_2 \xlongequal{一定条件} CH_3OH + H_2O}$44 3235.2 t x$\frac{32}{44}=\frac{x}{35.2\ t}$ $x=25.6$ t答:44 t ${CO_2}$理论上可制得甲醇的质量为25.6 t。
(1)${CO_2 + H_2O = H_2CO_3}$
(2)①${2NH_3 + CO_2 = NH_4COONH_4}$②氨水具有强挥发性,温度较高时,氨水挥发加快,不利于生成${NH_4HCO_3}$
(3)液态氨能吸收${CO_2}$原料气中的杂质气体,从而实现${CO_2}$与杂质气体的分离
(4)${CO_2 + CH_4 \xlongequal{催化剂} 2CO + 2H_2}$
(5)解:根据题目可知,44 t ${CO_2}$中能转化为甲醇的${CO_2}$的质量为44 t×80%=35.2 t,设理论上可制得甲醇的质量为x。${CO_2 + 3H_2 \xlongequal{一定条件} CH_3OH + H_2O}$44 3235.2 t x$\frac{32}{44}=\frac{x}{35.2\ t}$ $x=25.6$ t答:44 t ${CO_2}$理论上可制得甲醇的质量为25.6 t。
查看更多完整答案,请扫码查看


