第89页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
1. 用硝酸钾固体配制 50 g 溶质质量分数为10%的硝酸钾溶液,下列做法错误的是(
A.称量:用天平称量 5 g 硝酸钾
B.量取:用量筒量取 45 mL 蒸馏水
C.溶解:将硝酸钾倒入量筒中溶解
D.转移:将配好的溶液转移至试剂瓶
C
)A.称量:用天平称量 5 g 硝酸钾
B.量取:用量筒量取 45 mL 蒸馏水
C.溶解:将硝酸钾倒入量筒中溶解
D.转移:将配好的溶液转移至试剂瓶
答案:
C
2. 两种物质在不同温度下的溶解度如下表所示,则下列说法正确的是(
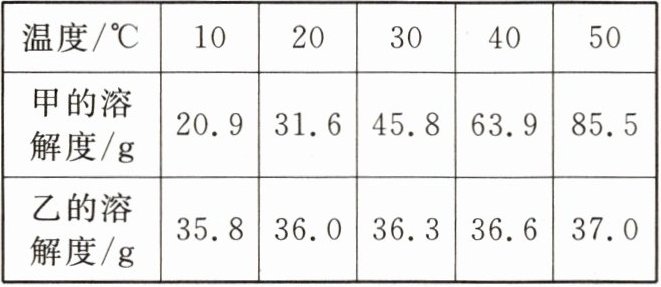
A.两种物质溶解度相等时的温度区间是 30~40 ℃
B.10 ℃时,100 g 甲溶液中最多可含甲的质量为 20.9 g
C.20 ℃时,将 68 g 乙的饱和溶液稀释到 20%,需加 22 g 水
D.30 ℃时,甲饱和溶液的溶质质量分数小于乙饱和溶液的溶质质量分数
C
)
A.两种物质溶解度相等时的温度区间是 30~40 ℃
B.10 ℃时,100 g 甲溶液中最多可含甲的质量为 20.9 g
C.20 ℃时,将 68 g 乙的饱和溶液稀释到 20%,需加 22 g 水
D.30 ℃时,甲饱和溶液的溶质质量分数小于乙饱和溶液的溶质质量分数
答案:
C
3. 要使 80 g ${NaCl}$ 溶液的溶质质量分数从 10%变为 20%,可(
A.蒸发 40 g 水
B.蒸发 36 g 水
C.加入 8 g ${NaCl}$
D.______
A
)A.蒸发 40 g 水
B.蒸发 36 g 水
C.加入 8 g ${NaCl}$
D.______
答案:
A;加入10g NaCl
4. 配制 50 g 溶质质量分数为 5%的 ${KNO3}$ 溶液,溶解过程中 ${KNO3}$ 溶液的溶质质量分数随时间的变化关系如图所示。据图分析,形成这种结果的原因可能是(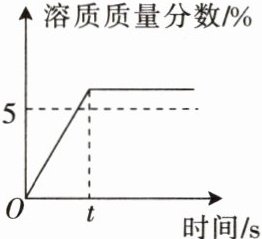
A.所用 ${KNO3}$ 固体中含有水分
B.用量筒量水时俯视刻度线
C.${KNO3}$ 固体溶解前所用烧杯内有水
D.用托盘天平称取 ${KNO3}$ 时,砝码放在左盘
C
)
A.所用 ${KNO3}$ 固体中含有水分
B.用量筒量水时俯视刻度线
C.${KNO3}$ 固体溶解前所用烧杯内有水
D.用托盘天平称取 ${KNO3}$ 时,砝码放在左盘
答案:
【解析】:
由图可知,最终配制的溶液溶质质量分数为$5\%$,而在$t$时刻时,溶质质量分数达到$5\%$后不再变化,说明在溶解过程中溶液已经达到了$5\%$的溶质质量分数,之后没有继续溶解更多溶质或者溶剂的量没有改变。
选项A:所用$KNO_3$固体中含有水分,这会导致实际称取的$KNO_3$质量偏小(因为含有水分,纯$KNO_3$的质量小于称取的总质量),根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶质质量偏小,会使配制的溶液溶质质量分数小于$5\%$,所以A选项错误。
选项B:用量筒量水时俯视刻度线,俯视读数会使量取的水的实际体积偏小,溶剂质量偏小,根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶液质量$=$溶质质量$+$溶剂质量,溶剂质量偏小,溶液质量偏小,溶质质量不变,会使配制的溶液溶质质量分数大于$5\%$,所以B选项错误。
选项C:$KNO_3$固体溶解前所用烧杯内有水,这会使溶剂的质量增加,根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶液质量$=$溶质质量$+$溶剂质量,溶剂质量增加,溶液质量增加,溶质质量不变,会使配制的溶液溶质质量分数小于$5\%$,在溶解过程中,随着$KNO_3$的溶解,溶质质量分数逐渐增大,当达到$5\%$后,由于烧杯内原本有水,继续溶解$KNO_3$直到溶解完,此时溶液中溶剂的量比正常情况(烧杯内无水)多,所以溶质质量分数会保持在$5\%$一段时间(即$t$时刻前),当$KNO_3$完全溶解后,溶质质量分数不再变化,符合图示情况,所以C选项正确。
选项D:用托盘天平称取$KNO_3$时,砝码放在左盘,若使用了游码,根据天平称量原理“左盘质量$=$右盘质量$+$游码质量”,会导致称取的$KNO_3$质量偏小(实际称取的质量$=$砝码质量$-$游码质量),根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶质质量偏小,会使配制的溶液溶质质量分数小于$5\%$,所以D选项错误。
【答案】:C
由图可知,最终配制的溶液溶质质量分数为$5\%$,而在$t$时刻时,溶质质量分数达到$5\%$后不再变化,说明在溶解过程中溶液已经达到了$5\%$的溶质质量分数,之后没有继续溶解更多溶质或者溶剂的量没有改变。
选项A:所用$KNO_3$固体中含有水分,这会导致实际称取的$KNO_3$质量偏小(因为含有水分,纯$KNO_3$的质量小于称取的总质量),根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶质质量偏小,会使配制的溶液溶质质量分数小于$5\%$,所以A选项错误。
选项B:用量筒量水时俯视刻度线,俯视读数会使量取的水的实际体积偏小,溶剂质量偏小,根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶液质量$=$溶质质量$+$溶剂质量,溶剂质量偏小,溶液质量偏小,溶质质量不变,会使配制的溶液溶质质量分数大于$5\%$,所以B选项错误。
选项C:$KNO_3$固体溶解前所用烧杯内有水,这会使溶剂的质量增加,根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶液质量$=$溶质质量$+$溶剂质量,溶剂质量增加,溶液质量增加,溶质质量不变,会使配制的溶液溶质质量分数小于$5\%$,在溶解过程中,随着$KNO_3$的溶解,溶质质量分数逐渐增大,当达到$5\%$后,由于烧杯内原本有水,继续溶解$KNO_3$直到溶解完,此时溶液中溶剂的量比正常情况(烧杯内无水)多,所以溶质质量分数会保持在$5\%$一段时间(即$t$时刻前),当$KNO_3$完全溶解后,溶质质量分数不再变化,符合图示情况,所以C选项正确。
选项D:用托盘天平称取$KNO_3$时,砝码放在左盘,若使用了游码,根据天平称量原理“左盘质量$=$右盘质量$+$游码质量”,会导致称取的$KNO_3$质量偏小(实际称取的质量$=$砝码质量$-$游码质量),根据溶质质量分数$=\frac{溶质质量}{溶液质量}×100\%$,溶质质量偏小,会使配制的溶液溶质质量分数小于$5\%$,所以D选项错误。
【答案】:C
5. 某同学配制 100 g 18%的氯化钠溶液,整个操作过程如下图所示,请填空。
 (1)配制溶液的正确操作顺序为______
(1)配制溶液的正确操作顺序为______
(2)已知砝码总质量为 15 g,游码移至 3 g 处,则实际称取的氯化钠质量为______
 (1)配制溶液的正确操作顺序为______
(1)配制溶液的正确操作顺序为______②①⑤③④
(填序号)。(2)已知砝码总质量为 15 g,游码移至 3 g 处,则实际称取的氯化钠质量为______
12
g。若其他操作正确,则该同学实际所配溶液的溶质质量分数为______12.8%
(计算结果保留至 0.1%)。
答案:
(1)②①⑤③④;
(2)12;12.8%
(1)②①⑤③④;
(2)12;12.8%
6. 将 70 g 氢氧化钠溶液与 81.8 g 硫酸铜溶液混合后恰好完全反应,得到 9.8 g 沉淀。[${CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓}$]
(1)反应后所得溶液质量为
(2)计算反应后溶液中溶质的质量分数。
(1)反应后所得溶液质量为
142
g。(2)计算反应后溶液中溶质的质量分数。
10%
答案:
(1) 142
(2) 10%
(1) 142
(2) 10%
查看更多完整答案,请扫码查看


