第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
9. 化学方程式${CuO + H2 \xlongequal{\triangle} Cu + H2O}$的正确读法是(
A.氧化铜加氢气等于铜加水
B.每80份质量的氧化铜与2份质量的氢气在加热条件下完全反应生成64份质量的铜和18份质量的水
C.氧化铜分子加氢分子加热后等于铜原子加水分子
D.______
B
)A.氧化铜加氢气等于铜加水
B.每80份质量的氧化铜与2份质量的氢气在加热条件下完全反应生成64份质量的铜和18份质量的水
C.氧化铜分子加氢分子加热后等于铜原子加水分子
D.______
答案:
B
10. (1)向a g过氧化氢溶液中加入2 g二氧化锰完全反应后剩余物质的质量是b g,则生成氧气的质量是
(2)化学反应${A \xlongequal{D} B + C}$中,D作催化剂,12 g A与3 g D混合并反应完全后生成了8 g B,则同时生成
(3)工业酒精中常含有少量甲醇。甲醇有毒,易挥发。请你根据甲醇在氧气中完全燃烧的产物是${CO2}和{H2O}$推断,甲醇中肯定含有
a + 2 - b
。(2)化学反应${A \xlongequal{D} B + C}$中,D作催化剂,12 g A与3 g D混合并反应完全后生成了8 g B,则同时生成
4
g C。(3)工业酒精中常含有少量甲醇。甲醇有毒,易挥发。请你根据甲醇在氧气中完全燃烧的产物是${CO2}和{H2O}$推断,甲醇中肯定含有
C、H
元素,还可能含有O
元素。
答案:
(1) a + 2 - b
(2) 4
(3) C、H;O
(1) a + 2 - b
(2) 4
(3) C、H;O
11. 认真观察化学方程式:${2KMnO4 \xlongequal{\triangle} K2MnO4 + MnO2 + O2↑}$,完成相关填空。
(1)该反应的反应物是
(2)该反应的条件是
(3)该反应中,${MnO2}和{O2}$的质量比为
(4)若加热31.6 g ${KMnO4}$粉末一段时间后,剩余固体总质量为28.4 g,则反应中生成氧气的质量为
(1)该反应的反应物是
高锰酸钾
,生成物是锰酸钾、二氧化锰和氧气
。(均填名称)(2)该反应的条件是
加热
。(3)该反应中,${MnO2}和{O2}$的质量比为
$87:32$
。(4)若加热31.6 g ${KMnO4}$粉末一段时间后,剩余固体总质量为28.4 g,则反应中生成氧气的质量为
$3.2$
g。
答案:
(1) 高锰酸钾;锰酸钾、二氧化锰和氧气
(2) 加热
(3) $87:32$
(4) $3.2$
(1) 高锰酸钾;锰酸钾、二氧化锰和氧气
(2) 加热
(3) $87:32$
(4) $3.2$
12. 酒精是乙醇的俗称,可用于医疗消毒,也常作燃料。为了测定乙醇的组成,现将一定质量的乙醇和氧气放在密闭容器中点燃,它们恰好完全反应,测得反应前后各物质的质量如下表所示。请填空。
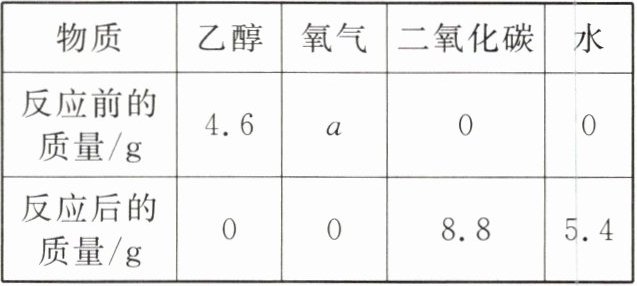
(1)a=
(2)生成物二氧化碳中碳元素的质量为
(3)由于氧气只含氧元素,故生成物中的碳元素和氢元素都来自反应物中的
(4)结合上面的计算结果可知,乙醇中一定含有氧元素,且4.6 g乙醇中氧元素的质量为

(1)a=
9.6
。(2)生成物二氧化碳中碳元素的质量为
2.4g
,水中氢元素的质量为0.6g
。(3)由于氧气只含氧元素,故生成物中的碳元素和氢元素都来自反应物中的
乙醇
。(4)结合上面的计算结果可知,乙醇中一定含有氧元素,且4.6 g乙醇中氧元素的质量为
1.6g
。
答案:
(1)解:根据质量守恒定律,反应前后物质的总质量相等。
反应前总质量 = 4.6g + a + 0 + 0 = 4.6g + a
反应后总质量 = 0 + 0 + 8.8g + 5.4g = 14.2g
则 4.6g + a = 14.2g,解得 a = 14.2g - 4.6g = 9.6g
答案:9.6
(2)解:二氧化碳中碳元素的质量 = 二氧化碳的质量 × 碳元素的质量分数
二氧化碳的相对分子质量 = 12 + 16×2 = 44
碳元素的质量分数 = 12/44
则碳元素质量 = 8.8g × (12/44) = 2.4g
水中氢元素的质量 = 水的质量 × 氢元素的质量分数
水的相对分子质量 = 1×2 + 16 = 18
氢元素的质量分数 = 2/18
则氢元素质量 = 5.4g × (2/18) = 0.6g
答案:2.4g;0.6g
(3)答案:乙醇
(4)解:乙醇中碳元素质量 = 2.4g,氢元素质量 = 0.6g
乙醇中碳、氢元素总质量 = 2.4g + 0.6g = 3.0g
乙醇的质量为 4.6g,则氧元素质量 = 4.6g - 3.0g = 1.6g
答案:1.6g
(1)解:根据质量守恒定律,反应前后物质的总质量相等。
反应前总质量 = 4.6g + a + 0 + 0 = 4.6g + a
反应后总质量 = 0 + 0 + 8.8g + 5.4g = 14.2g
则 4.6g + a = 14.2g,解得 a = 14.2g - 4.6g = 9.6g
答案:9.6
(2)解:二氧化碳中碳元素的质量 = 二氧化碳的质量 × 碳元素的质量分数
二氧化碳的相对分子质量 = 12 + 16×2 = 44
碳元素的质量分数 = 12/44
则碳元素质量 = 8.8g × (12/44) = 2.4g
水中氢元素的质量 = 水的质量 × 氢元素的质量分数
水的相对分子质量 = 1×2 + 16 = 18
氢元素的质量分数 = 2/18
则氢元素质量 = 5.4g × (2/18) = 0.6g
答案:2.4g;0.6g
(3)答案:乙醇
(4)解:乙醇中碳元素质量 = 2.4g,氢元素质量 = 0.6g
乙醇中碳、氢元素总质量 = 2.4g + 0.6g = 3.0g
乙醇的质量为 4.6g,则氧元素质量 = 4.6g - 3.0g = 1.6g
答案:1.6g
查看更多完整答案,请扫码查看


