第87页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
【变形】
2. 根据以下实验方案“探究参加化学反应前后各物质的质量总和是否相等”,请你思考,将实验结果写在横线上。
【猜想假设】猜想 1:相等;猜想 2:
【实验探究】

【反思评价】你认为猜想______是错误的,其原因是________________________。
2. 根据以下实验方案“探究参加化学反应前后各物质的质量总和是否相等”,请你思考,将实验结果写在横线上。
【猜想假设】猜想 1:相等;猜想 2:
不相等
。【实验探究】

【反思评价】你认为猜想______是错误的,其原因是________________________。
答案:
2.【猜想假设】不相等
【实验探究】铁钉表面有红色物质析出 不 向右
【反思评价】2 方案二的反应没有在密闭容器中进行,生成的二氧化碳气体逸出
【实验探究】铁钉表面有红色物质析出 不 向右
【反思评价】2 方案二的反应没有在密闭容器中进行,生成的二氧化碳气体逸出
3. 化学学习常用化学思维去认识和理解世界。下列说法正确的个数有(

① 反应中,甲和丙的质量变化比为$1:8$
② $x = 4$
③ 该反应为化合反应
④ 乙可能是催化剂
⑤ 若甲与丁的化学计量数之比为$2:3$,则其相对分子质量之比为$3:16$
A.1 个
B.2 个
C.3 个
D.4 个
D
)
① 反应中,甲和丙的质量变化比为$1:8$
② $x = 4$
③ 该反应为化合反应
④ 乙可能是催化剂
⑤ 若甲与丁的化学计量数之比为$2:3$,则其相对分子质量之比为$3:16$
A.1 个
B.2 个
C.3 个
D.4 个
答案:
3.D
4. 焊接钢轨的反应原理是:铝与氧化铁在高温条件下反应生成铁和氧化铝,该反应的化学方程式为
2Al+Fe_{2}O_{3} \overset{高温}{=}2Fe+Al_{2}O_{3}
。
答案:
$4.2Al+Fe_{2}O_{3} \overset{高温}{=}2Fe+Al_{2}O_{3}$
5. 一种新型复合光催化剂($C_3N_4/CQDs$)能利用太阳光分解水,原理如图所示。回答下列问题。
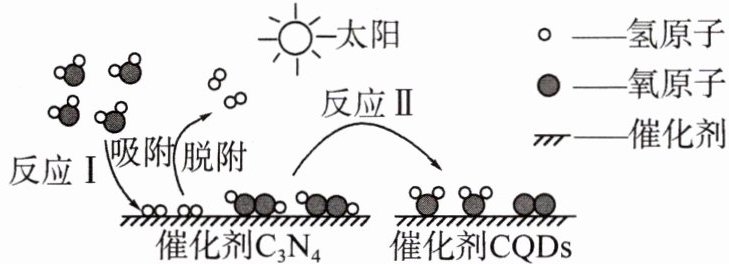
(1) 这个过程将________能转化为化学能。反应Ⅱ属于基本反应类型中的________。
(2) 写出反应Ⅰ的化学方程式:________________________。

(1) 这个过程将________能转化为化学能。反应Ⅱ属于基本反应类型中的________。
(2) 写出反应Ⅰ的化学方程式:________________________。
答案:
5.
(1)太阳 分解反应
$(2)2H_{2}O \overset{C_{3}N_{4}, 光照}{=}H_{2}\uparrow+H_{2}O_{2}$
(1)太阳 分解反应
$(2)2H_{2}O \overset{C_{3}N_{4}, 光照}{=}H_{2}\uparrow+H_{2}O_{2}$
6. 为了测定某石灰石矿中碳酸钙的含量,某兴趣小组进行了如下实验:称取$10g$石灰石样品,反复灼烧至质量不再改变,称得剩余固体质量为$6.7g$(反应的化学方程式为$CaCO_3\xlongequal{高温}CaO + CO_2↑$,杂质不参与反应)。请计算:
(1) 反应生成$CO_2$的质量为
(2) 该石灰石样品中碳酸钙的质量分数。(写出计算过程)
(1) 反应生成$CO_2$的质量为
3.3
g。(2) 该石灰石样品中碳酸钙的质量分数。(写出计算过程)
答案:
6.
(1)3.3
(2)解:设石灰石样品中碳酸钙的质量为x。
$CaCO_{3} \overset{高温}{=}CaO+CO_{2}\uparrow$
100 44
x 3.3 g
$\frac{100}{44}=\frac{x}{3.3 g}$
x=7.5 g
碳酸钙的质量分数为$\frac{7.5 g}{10 g}×100\%=75\%。$
答:该石灰石样品中碳酸钙的质量分数为75\%。
(1)3.3
(2)解:设石灰石样品中碳酸钙的质量为x。
$CaCO_{3} \overset{高温}{=}CaO+CO_{2}\uparrow$
100 44
x 3.3 g
$\frac{100}{44}=\frac{x}{3.3 g}$
x=7.5 g
碳酸钙的质量分数为$\frac{7.5 g}{10 g}×100\%=75\%。$
答:该石灰石样品中碳酸钙的质量分数为75\%。
查看更多完整答案,请扫码查看


