第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
1. 在制备较大颗粒的五水硫酸铜晶体时,需要注意的是(
①制备饱和溶液时,要防止溶液过饱和而析出晶体
②冷却速度要缓慢,用棉花或塑料泡沫保温,让饱和溶液缓慢冷却
③选用晶体时,应使用纯净的硫酸铜,防止灰尘落入溶液
④过滤要快,防止饱和溶液迅速冷却而析出晶体
A.①②④
B.①②③④
C.②③④
D.①③④
B
)①制备饱和溶液时,要防止溶液过饱和而析出晶体
②冷却速度要缓慢,用棉花或塑料泡沫保温,让饱和溶液缓慢冷却
③选用晶体时,应使用纯净的硫酸铜,防止灰尘落入溶液
④过滤要快,防止饱和溶液迅速冷却而析出晶体
A.①②④
B.①②③④
C.②③④
D.①③④
答案:
1.B
2. 兴趣小组的同学利用单质铜制备硫酸铜,设计了甲、乙两个实验方案:
甲:${Cu\xrightarrow[{\triangle }]{O_{2}}CuO\xrightarrow[{\triangle }]{稀硫酸}CuSO_{4}}$(已知:${CuO + H_{2}SO_{4}\xlongequal{\triangle }CuSO_{4} + H_{2}O}$)
乙:${Cu\xrightarrow[{\triangle }]{浓硫酸}CuSO_{4}}$[已知:${Cu + 2H_{2}SO_{4}(浓)\xlongequal{\triangle }CuSO_{4} + SO_{2}\uparrow + 2H_{2}O}$]
下列有关上述实验方案的说法中,不正确的是(
A.上述两个方案中,更环保的是方案甲
B.方案乙中生成的${SO_{2}}$是计入空气质量报告的一种污染物
C.取相同质量的单质铜,方案乙制得的硫酸铜比方案甲多
D.制取同一种物质可以采用不同的实验方案
甲:${Cu\xrightarrow[{\triangle }]{O_{2}}CuO\xrightarrow[{\triangle }]{稀硫酸}CuSO_{4}}$(已知:${CuO + H_{2}SO_{4}\xlongequal{\triangle }CuSO_{4} + H_{2}O}$)
乙:${Cu\xrightarrow[{\triangle }]{浓硫酸}CuSO_{4}}$[已知:${Cu + 2H_{2}SO_{4}(浓)\xlongequal{\triangle }CuSO_{4} + SO_{2}\uparrow + 2H_{2}O}$]
下列有关上述实验方案的说法中,不正确的是(
C
)A.上述两个方案中,更环保的是方案甲
B.方案乙中生成的${SO_{2}}$是计入空气质量报告的一种污染物
C.取相同质量的单质铜,方案乙制得的硫酸铜比方案甲多
D.制取同一种物质可以采用不同的实验方案
答案:
2.C
3. 学习小组开展“制备‘蓝宝石’(五水硫酸铜晶体)”的跨学科实践活动,查得硫酸铜的溶解度曲线如图所示。
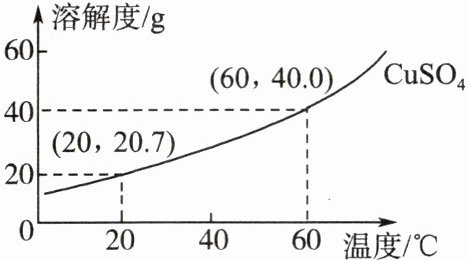
(1)制备$60\ ^{\circ}C$时的硫酸铜饱和溶液用
(2)制作晶核
将上述$60\ ^{\circ}C$的硫酸铜饱和溶液用硬纸片盖好,静置一夜(忽略水分的变化);选取一个溶液中出现的较完整的小晶体作为晶核。
①制作晶核的这种方法称为
②结合硫酸铜溶解度曲线解释,采用该方法的原理是
(3)获得“蓝宝石”
将晶核用丝线绑住,完全浸没在重新配制好的$60\ ^{\circ}C$的硫酸铜饱和溶液中,用硬纸片盖好,静置,一段时间后可获得“长大”的美丽“蓝宝石”。
①若获得“蓝宝石”后的剩余溶液温度为$20\ ^{\circ}C$,则此时溶液的溶质质量分数为
②“蓝宝石”的成分为${CuSO_{4}\cdot 5H_{2}O}$,其相对分子质量为250,“蓝宝石”中铜元素的质量分数为

(1)制备$60\ ^{\circ}C$时的硫酸铜饱和溶液用
量筒
和胶头滴管量取$100\ mL$蒸馏水,用天平称取40.0
g硫酸铜,将硫酸铜溶于蒸馏水中,配制成$60\ ^{\circ}C$的硫酸铜饱和溶液。(2)制作晶核
将上述$60\ ^{\circ}C$的硫酸铜饱和溶液用硬纸片盖好,静置一夜(忽略水分的变化);选取一个溶液中出现的较完整的小晶体作为晶核。
①制作晶核的这种方法称为
降温
结晶。②结合硫酸铜溶解度曲线解释,采用该方法的原理是
硫酸铜的溶解度随温度降低而减小
。(3)获得“蓝宝石”
将晶核用丝线绑住,完全浸没在重新配制好的$60\ ^{\circ}C$的硫酸铜饱和溶液中,用硬纸片盖好,静置,一段时间后可获得“长大”的美丽“蓝宝石”。
①若获得“蓝宝石”后的剩余溶液温度为$20\ ^{\circ}C$,则此时溶液的溶质质量分数为
$\frac{20.7\ g}{100\ g+20.7\ g}$$× 100\%$
(列出计算式即可)。②“蓝宝石”的成分为${CuSO_{4}\cdot 5H_{2}O}$,其相对分子质量为250,“蓝宝石”中铜元素的质量分数为
25.6%
。
答案:
3.
(1)量筒 40.0
(2)①降温 ②硫酸铜的溶解度随温度降低而减小
(3)①$\frac{20.7\ g}{100\ g+20.7\ g}$$× 100\%$②25.6%
(1)量筒 40.0
(2)①降温 ②硫酸铜的溶解度随温度降低而减小
(3)①$\frac{20.7\ g}{100\ g+20.7\ g}$$× 100\%$②25.6%
查看更多完整答案,请扫码查看


