第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
10. 海洋是个巨大的宝藏,人类利用海洋化学资源的过程大体上经历了如图所示的几个阶段。

(1) 氯碱工业基本流程如下:

由图示可知,电解饱和食盐水获取烧碱的化学方程式为
(2) 海水提镁流程:海水(${MgCl_{2}}$)$\xrightarrow{a}$氢氧化镁$\xrightarrow{b}$氯化镁$\xrightarrow{c}$镁。写出其中任意一个反应的化学方程式:
(3) 下列方法中,能淡化海水的是
A. 过滤法
B. 沉淀法
C. 多级闪急蒸馏法
D. 分解法

(1) 氯碱工业基本流程如下:

由图示可知,电解饱和食盐水获取烧碱的化学方程式为
2NaCl+2H₂O$\xlongequal{通电}$2NaOH+Cl₂↑+H₂↑
。该工艺中,可以循环利用的物质是NaCl
。(2) 海水提镁流程:海水(${MgCl_{2}}$)$\xrightarrow{a}$氢氧化镁$\xrightarrow{b}$氯化镁$\xrightarrow{c}$镁。写出其中任意一个反应的化学方程式:
MgCl₂+Ca(OH)₂=Mg(OH)₂↓+CaCl₂
。提取氯化镁历经a、b两步转换的目的是富集并提纯氯化镁
。(3) 下列方法中,能淡化海水的是
C
(填字母)。A. 过滤法
B. 沉淀法
C. 多级闪急蒸馏法
D. 分解法
答案:
(1)2NaCl+2H₂O$\xlongequal{通电}$2NaOH+Cl₂↑+H₂↑ NaCl
(2)MgCl₂+Ca(OH)₂=Mg(OH)₂↓+CaCl₂ 富集并提纯氯化镁
(3)C
(1)2NaCl+2H₂O$\xlongequal{通电}$2NaOH+Cl₂↑+H₂↑ NaCl
(2)MgCl₂+Ca(OH)₂=Mg(OH)₂↓+CaCl₂ 富集并提纯氯化镁
(3)C
$11. $氯化镁是一种重要的化工原料$,$同学们在实验室对其开展了一系列研究。
课题$1$:选择制取氯化镁的原料
$【$查阅资料$】$
$①$全球海水中含有的盐类的总质量为$5$亿亿吨$,$其中含有的各种离子占盐类总质量的百分含量如表所示:
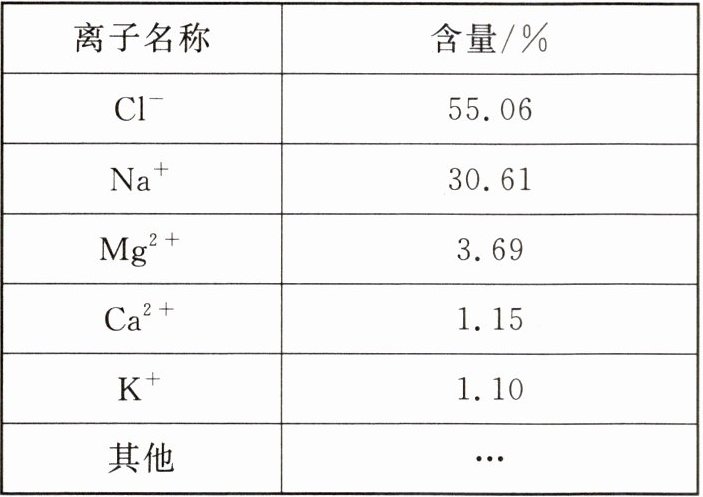
$②$工业生产中海水或卤水$($海水$“$晒盐$”$后的剩余溶液$)$都可以作为制取氯化镁的原料。
$【$交流讨论$】$
同学们经讨论$,$一致选择卤水用于实验室制取氯化镁。你认为他们的理由是______。
课题$2$:由卤水制取氯化镁
同学们设计如图所示方案$,$从卤水中制取氯化镁。

$(1) $溶液$X$的名称是______。
$(2) $部分同学认为上述制取方案不够完善$,$在$“$过滤$”$操作后缺少$“$洗涤$”$操作$,$从而导致制取的氯化镁不纯$,$可能混有的杂质是______。
课题$3$:测定氯化镁产品的纯度$($测定氯化镁的质量分数$)$
同学们设计如下实验方案对制得的氯化镁的纯度进行测定。
$【$实验步骤$】$
$①$称取$9.5\ {g}$氯化镁样品$,$放于烧杯中$,$加足量的水溶解$,$形成溶液。
$②$向上述溶液中加入$90\ {g}$溶质质量分数为$10\%$的氢氧化钠溶液。
$③$充分反应后$,$过滤。
$④……⑤$向所得溶液中加入几滴无色酚酞试液$,$溶液变红;再逐滴加入$10\%$稀硫酸$($密度为$1.07\ {g\cdot mL^{-1}}),$并______;当观察到溶液恰好褪色且$30\ {s}$内红色不再出现时$,$停止加入稀硫酸。
$⑥$计算氯化镁样品的纯度。
$【$问题讨论$】$
$(1) $为计算出氯化镁样品的纯度$,$除上述数据外$,$实验还需测量的数据是______。
$(2) $若缺少步骤$④,$则会导致氯化镁纯度测定不准确。步骤$④$的操作是______。
课题$1$:选择制取氯化镁的原料
$【$查阅资料$】$
$①$全球海水中含有的盐类的总质量为$5$亿亿吨$,$其中含有的各种离子占盐类总质量的百分含量如表所示:

$②$工业生产中海水或卤水$($海水$“$晒盐$”$后的剩余溶液$)$都可以作为制取氯化镁的原料。
$【$交流讨论$】$
同学们经讨论$,$一致选择卤水用于实验室制取氯化镁。你认为他们的理由是______。
课题$2$:由卤水制取氯化镁
同学们设计如图所示方案$,$从卤水中制取氯化镁。

$(1) $溶液$X$的名称是______。
$(2) $部分同学认为上述制取方案不够完善$,$在$“$过滤$”$操作后缺少$“$洗涤$”$操作$,$从而导致制取的氯化镁不纯$,$可能混有的杂质是______。
课题$3$:测定氯化镁产品的纯度$($测定氯化镁的质量分数$)$
同学们设计如下实验方案对制得的氯化镁的纯度进行测定。
$【$实验步骤$】$
$①$称取$9.5\ {g}$氯化镁样品$,$放于烧杯中$,$加足量的水溶解$,$形成溶液。
$②$向上述溶液中加入$90\ {g}$溶质质量分数为$10\%$的氢氧化钠溶液。
$③$充分反应后$,$过滤。
$④……⑤$向所得溶液中加入几滴无色酚酞试液$,$溶液变红;再逐滴加入$10\%$稀硫酸$($密度为$1.07\ {g\cdot mL^{-1}}),$并______;当观察到溶液恰好褪色且$30\ {s}$内红色不再出现时$,$停止加入稀硫酸。
$⑥$计算氯化镁样品的纯度。
$【$问题讨论$】$
$(1) $为计算出氯化镁样品的纯度$,$除上述数据外$,$实验还需测量的数据是______。
$(2) $若缺少步骤$④,$则会导致氯化镁纯度测定不准确。步骤$④$的操作是______。
答案:
课题 1:卤水中氯化镁的含量高 课题 2:
(1)稀盐酸
(2)NaCl、KCl、CaCl₂ 等 课题 3:用玻璃棒不断搅拌
(1)溶液恰好褪色且 30 s 内红色不再出现时加入硫酸的体积
(2)用水充分洗涤滤渣,并将洗涤液与滤液合并
(1)稀盐酸
(2)NaCl、KCl、CaCl₂ 等 课题 3:用玻璃棒不断搅拌
(1)溶液恰好褪色且 30 s 内红色不再出现时加入硫酸的体积
(2)用水充分洗涤滤渣,并将洗涤液与滤液合并
查看更多完整答案,请扫码查看


