2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第90页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
一、弱电解质的电离平衡
1. 弱电解质电离平衡的建立
(1) 弱电解质电离过程中离子生成和结合成分子的速率随时间的变化(如图所示)。
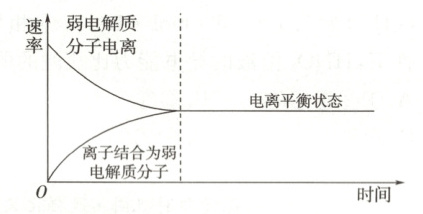
(2) 电离平衡概念。
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率,溶液中弱电解质分子和离子的浓度都不再,弱电解质的电离达到了电离平衡状态。
(3) 电离平衡的特征。

(4) 影响电离平衡的因素。
① 内因:由电解质本身的性质决定。电解质越弱,其电离程度越小。
② 外因:
a. 温度:升温时,电离平衡向方向移动。
b. 浓度:降低浓度(加水),电离平衡向方向移动。
c. 加入含有弱电解质离子的强电解质,电离平衡向的方向移动。
2. 电离方程式的书写
(1) 定义:表示电解质电离过程的式子。
(2) 表示方法:
① 强电解质的电离方程式用 “$=$” 连接;弱电解质的电离方程式用 “$\rightleftharpoons$” 连接。${CH_{3}COOH}$、${NH_{3}· H_{2}O}$ 的电离方程式分别为、。
② 多元弱酸分步电离、分步书写,以第一步电离为主,如 ${H_{2}CO_{3}}$ 的电离方程式为 ${H_{2}CO_{3}\rightleftharpoons HCO^{-}_{3} + H^{+}}$、${HCO^{-}_{3}\rightleftharpoons CO^{2-}_{3} + H^{+}}$。
③ 多元弱碱分步电离、一步书写,如 ${Fe(OH)_{3}\rightleftharpoons}$。
1. 弱电解质电离平衡的建立
(1) 弱电解质电离过程中离子生成和结合成分子的速率随时间的变化(如图所示)。

(2) 电离平衡概念。
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率,溶液中弱电解质分子和离子的浓度都不再,弱电解质的电离达到了电离平衡状态。
(3) 电离平衡的特征。

(4) 影响电离平衡的因素。
① 内因:由电解质本身的性质决定。电解质越弱,其电离程度越小。
② 外因:
a. 温度:升温时,电离平衡向方向移动。
b. 浓度:降低浓度(加水),电离平衡向方向移动。
c. 加入含有弱电解质离子的强电解质,电离平衡向的方向移动。
2. 电离方程式的书写
(1) 定义:表示电解质电离过程的式子。
(2) 表示方法:
① 强电解质的电离方程式用 “$=$” 连接;弱电解质的电离方程式用 “$\rightleftharpoons$” 连接。${CH_{3}COOH}$、${NH_{3}· H_{2}O}$ 的电离方程式分别为、。
② 多元弱酸分步电离、分步书写,以第一步电离为主,如 ${H_{2}CO_{3}}$ 的电离方程式为 ${H_{2}CO_{3}\rightleftharpoons HCO^{-}_{3} + H^{+}}$、${HCO^{-}_{3}\rightleftharpoons CO^{2-}_{3} + H^{+}}$。
③ 多元弱碱分步电离、一步书写,如 ${Fe(OH)_{3}\rightleftharpoons}$。
答案:
1.
(2)相等 发生变化
(3)弱电解质 = 保持不变
(4)②a.电离 b.电离 c.离子结合成分子 2.
(2)①CH${3}$COOH⇌CH${3}$COO$^{-}$+H${+}$ NH${3}$·H${2}$O⇌NH${4}^{+}$+OH$^{-}$ ③Fe${3+}$+3OH$^{-}$
(2)相等 发生变化
(3)弱电解质 = 保持不变
(4)②a.电离 b.电离 c.离子结合成分子 2.
(2)①CH${3}$COOH⇌CH${3}$COO$^{-}$+H${+}$ NH${3}$·H${2}$O⇌NH${4}^{+}$+OH$^{-}$ ③Fe${3+}$+3OH$^{-}$
判一判 (正确的打 “√”,错误的打 “×”)
(1) 电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。 (
(2) $25^{\circ} C$ 时,$0.1\ mol· L^{-1}{CH_{3}COOH}$ 溶液加水稀释,各离子浓度均减小。 (
(3) 电离平衡向右移动,弱电解质的电离程度一定增大。 (
(4) ${H_{2}S}$ 的电离方程式为 ${H_{2}S\rightleftharpoons 2H^{+} + S^{2-}}$。 (
(5) ${NaHSO_{4}}$ 在水溶液中的电离方程式为 ${NaHSO_{4}=Na^{+} + HSO^{-}_{4}}$。 (
(6) ${BaSO_{4}}$ 溶于水,导电性很弱,故电离方程式为 ${BaSO_{4}\rightleftharpoons Ba^{2+} + SO^{2-}_{4}}$。 (
(1) 电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。 (
×
)(2) $25^{\circ} C$ 时,$0.1\ mol· L^{-1}{CH_{3}COOH}$ 溶液加水稀释,各离子浓度均减小。 (
×
)(3) 电离平衡向右移动,弱电解质的电离程度一定增大。 (
×
)(4) ${H_{2}S}$ 的电离方程式为 ${H_{2}S\rightleftharpoons 2H^{+} + S^{2-}}$。 (
×
)(5) ${NaHSO_{4}}$ 在水溶液中的电离方程式为 ${NaHSO_{4}=Na^{+} + HSO^{-}_{4}}$。 (
×
)(6) ${BaSO_{4}}$ 溶于水,导电性很弱,故电离方程式为 ${BaSO_{4}\rightleftharpoons Ba^{2+} + SO^{2-}_{4}}$。 (
×
)
答案:
(1)×
(2)×
(3)×
(4)×
(5)×
(6)×
(1)×
(2)×
(3)×
(4)×
(5)×
(6)×
查看更多完整答案,请扫码查看


