2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第33页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
1. 下列有关用惰性电极电解 ${AgNO_{3}}$ 溶液一段时间后的说法,正确的是(
A.电解过程中阳极的质量不断增加
B.电解过程中溶液的 pH 不断升高
C.此时向溶液中加入适量的 ${Ag_{2}O}$ 固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为 $2:1$
C
)A.电解过程中阳极的质量不断增加
B.电解过程中溶液的 pH 不断升高
C.此时向溶液中加入适量的 ${Ag_{2}O}$ 固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为 $2:1$
答案:
1.C [用惰性电极电解AgNO3溶液,总的电解反应式为4AgNO3 + 2H2O 通电 ══ 4Ag + O2↑ + 4HNO3,阴极上析出Ag,阳极上放出O2,A、D错误;由于生成HNO3,溶液的pH降低,B错误;要使溶液恢复到电解前的状况要加入的物质应是Ag2O,C正确。]
2. 如图中 X、Y 分别是直流电源的两极,通电后发现 a 极板质量增加,b 极板处有无色无味气体放出。符合这一情况的是表中的(
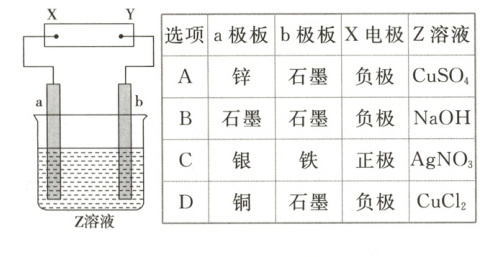
A
)
答案:
2.A [由a极板质量增加知,溶液中阳离子在a极板处析出,则a为阴极,X为负极,因B中a极板处不析出金属、C中X为正极可知B、C均错误;又由b极板处有无色无味气体放出可知D错误。]
3. 用惰性电极电解下列电解质的溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是(
A.$NaCl$[盐酸]|
B.$NaOH$[${H_{2}O}$]|
C.${CuCl_{2}}$[HCl]|
D.${CuSO_{4}}$[${Cu(OH)_{2}}$]|
B
)A.$NaCl$[盐酸]|
B.$NaOH$[${H_{2}O}$]|
C.${CuCl_{2}}$[HCl]|
D.${CuSO_{4}}$[${Cu(OH)_{2}}$]|
答案:
3.B [电解NaCl溶液时,阳极氯离子放电生成氯气,阴极氢离子得到电子生成氢气,所以应加HCl让电解质溶液复原,A错误;电解NaOH溶液时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B正确;电解CuCl2溶液时,阳极氯离子放电生成氯气,阴极析出铜,所以应加氯化铜让电解质溶液复原,C错误;电解硫酸铜溶液时,阳极产生氧气,阴极产生金属铜,所以应加CuO或CuCO3让电解质溶液复原,加入氢氧化铜会多生成水,D错误。]
4. 用如图所示的装置进行电解。通电后发现湿润的淀粉 - KI 试纸的 C 端变为蓝色。
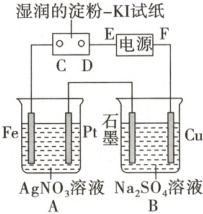
(1) E 为电源的
(2) A 中发生反应的化学方程式为
(3) 在 B 中观察到的现象是
(4) D 端的电极反应式为

(1) E 为电源的
负
极,F 为电源的正
极。(2) A 中发生反应的化学方程式为
4AgNO3 + 2H2O 通电 ══ 4Ag + 4HNO3 + O2↑
。(3) 在 B 中观察到的现象是
铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
。(4) D 端的电极反应式为
2H2O + 2e- ══ 2OH- + H2↑
。
答案:
4.解析:本题实质上是三个电解装置串联,由题中信息可知C为阳极、D为阴极,则E为负极,F为正极。A中是以Pt为阳极、Fe为阴极电解AgNO3溶液。B中Cu为阳极,发生的反应为Cu - 2e- ══ Cu2+,石墨为阴极,发生的反应为2H2O + 2e- ══ 2OH- + H2↑,由于水电离出的H+放电,所以溶液中的c(OH-)增大,故溶液中有氢氧化铜蓝色沉淀生成。D端为阴极,发生的电极反应为2H2O + 2e- ══ 2OH- + H2↑。
答案:
(1)负 正
(2)4AgNO3 + 2H2O 通电 ══ 4Ag + 4HNO3 + O2↑
(3)铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)2H2O + 2e- ══ 2OH- + H2↑
答案:
(1)负 正
(2)4AgNO3 + 2H2O 通电 ══ 4Ag + 4HNO3 + O2↑
(3)铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)2H2O + 2e- ══ 2OH- + H2↑
1. 电解饱和食盐水
(1)装置
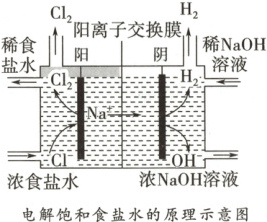
(2)现象
阳极上有
(3)原理分析及电极反应
电解时,
①阳极离子放电顺序:
②阴极离子放电顺序:
③电解反应
化学方程式:
【特别提醒】阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。既能防止阴极产生的H₂和阳极产生的Cl₂混合而引起爆炸,又能避免Cl₂和NaOH反应影响烧碱质量。
(1)装置

(2)现象
阳极上有
黄绿色
气体产生;阴极上有无色
气体产生。(3)原理分析及电极反应
电解时,
Cl⁻、OH⁻
移向阳极,H⁺、Na⁺
移向阴极。①阳极离子放电顺序:
Cl⁻>OH⁻
,电极反应式:2Cl⁻ - 2e⁻ = Cl₂↑
(氧化
反应)。②阴极离子放电顺序:
H⁺>Na⁺
,电极反应式:2H₂O + 2e⁻ = 2OH⁻ + H₂↑
(还原
反应)。③电解反应
化学方程式:
$2NaCl + 2H₂O \xlongequal{通电} 2NaOH + H₂↑ + Cl₂↑$
,离子方程式:$2Cl⁻ + 2H₂O \xlongequal{通电} 2OH⁻ + H₂↑ + Cl₂↑$
。【特别提醒】阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。既能防止阴极产生的H₂和阳极产生的Cl₂混合而引起爆炸,又能避免Cl₂和NaOH反应影响烧碱质量。
答案:
1.(2)黄绿色 无色 (3)Cl⁻、OH⁻ H⁺、Na⁺ ①Cl⁻>OH⁻ 2Cl⁻ - 2e⁻ = Cl₂↑ 氧化 ②H⁺>Na⁺ 2H₂O + 2e⁻ = 2OH⁻ + H₂↑ 还原$ ③2NaCl + 2H₂O \xlongequal{通电} 2NaOH + H₂↑ + Cl₂↑ 2Cl⁻ + 2H₂O \xlongequal{通电} 2OH⁻ + H₂↑ + Cl₂↑$
查看更多完整答案,请扫码查看


