2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
中和热的测定是高中化学的定量实验之一,如图装置是某同学利用 $50\ mL\ 0.50\ mol· L^{-1}$ 盐酸与 $50\ mL\ 0.55\ mol· L^{-1}\ NaOH$ 溶液进行中和反应。通过测定反应过程中所放出的热量计算中和热。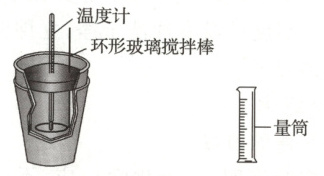
[问题探究]
[问题 1] 测定 $ NaOH$ 溶液的温度前,温度计上的盐酸为什么要用水冲洗干净?冲洗后的溶液能否倒入盐酸中?其原因是什么?
[问题 2] 盐酸和 $ NaOH$ 溶液混合时,为什么要将量筒中的 $ NaOH$ 溶液一次性倒入盐酸中而不能缓慢 (或分多次) 倒入?
[问题 3] 实验中为何使用 $0.55\ mol· L^{-1}\ NaOH$ 溶液与 $0.50\ mol· L^{-1}$ 盐酸反应,而不是选用 $0.50\ mol· L^{-1}\ NaOH$ 溶液?
[问题 4] 用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?若用稀硫酸和稀 $ Ba(OH)_2$ 溶液测定中和反应反应热,对结果会产生什么影响?

[问题探究]
[问题 1] 测定 $ NaOH$ 溶液的温度前,温度计上的盐酸为什么要用水冲洗干净?冲洗后的溶液能否倒入盐酸中?其原因是什么?
[问题 2] 盐酸和 $ NaOH$ 溶液混合时,为什么要将量筒中的 $ NaOH$ 溶液一次性倒入盐酸中而不能缓慢 (或分多次) 倒入?
[问题 3] 实验中为何使用 $0.55\ mol· L^{-1}\ NaOH$ 溶液与 $0.50\ mol· L^{-1}$ 盐酸反应,而不是选用 $0.50\ mol· L^{-1}\ NaOH$ 溶液?
[问题 4] 用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?若用稀硫酸和稀 $ Ba(OH)_2$ 溶液测定中和反应反应热,对结果会产生什么影响?
答案:
[问题探究]
问题1 提示:测定$\mathrm{NaOH}$溶液的温度时,若温度计上沾有酸,二者反应放出热量,测得$\mathrm{NaOH}$溶液的温度偏高;冲洗后的溶液不能倒入盐酸中,若倒入,会使混合液的总质量增加,导致实验结果产生误差。
问题2 提示:本实验的关键是测反应的反应热,若动作迟缓(或分多次倒入),会使热量损失而使误差增大。
问题3 提示:碱过量的目的是保证盐酸完全反应。
问题4 提示:浓硫酸溶于水时放热,所测反应热的数值偏大;弱酸、弱碱电离吸热,所测反应热的数值偏小;若用稀硫酸和稀$\mathrm{Ba(OH)_{2}}$溶液测定反应热,生成$\mathrm{BaSO_{4}}$沉淀还会多放出一部分热量,所测反应热的数值偏大。
问题1 提示:测定$\mathrm{NaOH}$溶液的温度时,若温度计上沾有酸,二者反应放出热量,测得$\mathrm{NaOH}$溶液的温度偏高;冲洗后的溶液不能倒入盐酸中,若倒入,会使混合液的总质量增加,导致实验结果产生误差。
问题2 提示:本实验的关键是测反应的反应热,若动作迟缓(或分多次倒入),会使热量损失而使误差增大。
问题3 提示:碱过量的目的是保证盐酸完全反应。
问题4 提示:浓硫酸溶于水时放热,所测反应热的数值偏大;弱酸、弱碱电离吸热,所测反应热的数值偏小;若用稀硫酸和稀$\mathrm{Ba(OH)_{2}}$溶液测定反应热,生成$\mathrm{BaSO_{4}}$沉淀还会多放出一部分热量,所测反应热的数值偏大。
查看更多完整答案,请扫码查看


