2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年课堂新坐标高中同步导学案高中化学选择性必修第一册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
三、燃料电池
1. 燃料电池
利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。燃料电池种类很多,如氢氧燃料电池是以氢气为燃料,氧气为氧化剂的燃料电池。
2. 氢氧燃料电池
(1) 氢氧燃料电池原理示意图。
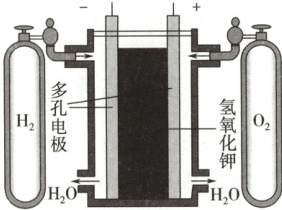
(2) 氢氧燃料电池工作原理。

(3) 电池特点。
① 能量转换率高,污染小。
② 工作时,燃料和氧化剂连续地由外部供给,在电极上不断进行反应,连续不断地提供电能。
【特别提醒】 (1) 燃料电池的两个电极与其他电池不同,电极材料本身不参与电极反应。
(2) 酸性介质中的燃料电池(氧化剂为${O_{2}}$)的正极反应式为${O_{2} + 4e^{-} + 4H^{+}=2H_{2}O}$;
碱性介质中的燃料电池(氧化剂为${O_{2}}$)的正极反应式为${O_{2} + 4e^{-} + 2H_{2}O=4OH^{-}}$。
1. 燃料电池
利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。燃料电池种类很多,如氢氧燃料电池是以氢气为燃料,氧气为氧化剂的燃料电池。
2. 氢氧燃料电池
(1) 氢氧燃料电池原理示意图。

(2) 氢氧燃料电池工作原理。

(3) 电池特点。
① 能量转换率高,污染小。
② 工作时,燃料和氧化剂连续地由外部供给,在电极上不断进行反应,连续不断地提供电能。
【特别提醒】 (1) 燃料电池的两个电极与其他电池不同,电极材料本身不参与电极反应。
(2) 酸性介质中的燃料电池(氧化剂为${O_{2}}$)的正极反应式为${O_{2} + 4e^{-} + 4H^{+}=2H_{2}O}$;
碱性介质中的燃料电池(氧化剂为${O_{2}}$)的正极反应式为${O_{2} + 4e^{-} + 2H_{2}O=4OH^{-}}$。
答案:
三、2.
(2)$2 H_2 - 4 e^- + 4 OH^- \xlongequal{} 4 H_2 O$ $ O_2 + 4 e^- + 2 H_2 O \xlongequal{} 4 OH^-$ $2 H_2 + O_2 \xlongequal{} 2 H_2 O$
(2)$2 H_2 - 4 e^- + 4 OH^- \xlongequal{} 4 H_2 O$ $ O_2 + 4 e^- + 2 H_2 O \xlongequal{} 4 OH^-$ $2 H_2 + O_2 \xlongequal{} 2 H_2 O$
判一判
(正确的打“√”,错误的打“×”)
(1) 燃料电池所有能量均转化为电能。(
(2) 燃料电池中通入燃料的一极为正极。(
(3) 氢氧燃料电池(酸性电解质)中${O_{2}}$通入正极,电极反应为${O_{2} + 4H^{+} + 4e^{-}=2H_{2}O}$。(
(4) 燃料电池电极材料本身不参与化学反应。(
(正确的打“√”,错误的打“×”)
(1) 燃料电池所有能量均转化为电能。(
×
)(2) 燃料电池中通入燃料的一极为正极。(
×
)(3) 氢氧燃料电池(酸性电解质)中${O_{2}}$通入正极,电极反应为${O_{2} + 4H^{+} + 4e^{-}=2H_{2}O}$。(
√
)(4) 燃料电池电极材料本身不参与化学反应。(
√
)
答案:
判一判
(1)×
(2)×
(3)√
(4)√
(1)×
(2)×
(3)√
(4)√
燃料电池是化学对人类的一项重大贡献,用两根铂丝作电极插入$NaOH$溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——甲烷燃料电池。如图是甲烷燃料电池原理示意图。
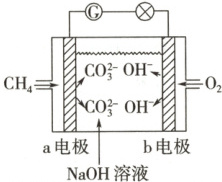
[问题探究]
[问题1] 燃料电池供电时燃料会燃烧吗?燃料电池的优点有哪些?
[问题2] 甲烷燃料电池的正负极如何判断?
[问题3] 写出用$NaOH$作电解质溶液时两极的电极反应式。
[问题4] 用稀${H_{2}SO_{4}}$作电解质溶液时,甲烷燃料电池的正负极反应式和(3)相同吗?应如何书写?

[问题探究]
[问题1] 燃料电池供电时燃料会燃烧吗?燃料电池的优点有哪些?
[问题2] 甲烷燃料电池的正负极如何判断?
[问题3] 写出用$NaOH$作电解质溶液时两极的电极反应式。
[问题4] 用稀${H_{2}SO_{4}}$作电解质溶液时,甲烷燃料电池的正负极反应式和(3)相同吗?应如何书写?
答案:
[问题探究]
问题1 提示:不会。燃料电池是燃料与氧化剂分别在两个电极上反应,将化学能直接转化为电能,不会发生燃烧转化为热能。优点:燃料电池能量转化率高,超过80%,,污染小。
问题2 提示:通$ O_2$一端得电子为正极,通$ CH_4$一端失电子为负极。
问题3 提示:因为$ CO_2$与$ NaOH$溶液反应生成$ Na_2 CO_3$,故总反应式为$ CH_4 + 2 O_2 + 2 NaOH \xlongequal{} Na_2 CO_3 + 3 H_2 O$,其中正极反应式为$2 O_2 + 4 H_2 O + 8 e^- \xlongequal{} 8 OH^-$,负极反应式为$ CH_4 + 10 OH^- - 8 e^- \xlongequal{} CO_3^{2-} + 7 H_2 O$。
问题4 提示:不同,相反应式是甲烷燃烧的化学方程式$ CH_4 + 2 O_2 \xlongequal{} CO_2 + 2 H_2 O$,其中正极反应式为$2 O_2 + 8 H^+ + 8 e^- \xlongequal{} 4 H_2 O$,负极反应式为$ CH_4 - 8 e^- + 2 H_2 O \xlongequal{} CO_2 + 8 H^+$。
问题1 提示:不会。燃料电池是燃料与氧化剂分别在两个电极上反应,将化学能直接转化为电能,不会发生燃烧转化为热能。优点:燃料电池能量转化率高,超过80%,,污染小。
问题2 提示:通$ O_2$一端得电子为正极,通$ CH_4$一端失电子为负极。
问题3 提示:因为$ CO_2$与$ NaOH$溶液反应生成$ Na_2 CO_3$,故总反应式为$ CH_4 + 2 O_2 + 2 NaOH \xlongequal{} Na_2 CO_3 + 3 H_2 O$,其中正极反应式为$2 O_2 + 4 H_2 O + 8 e^- \xlongequal{} 8 OH^-$,负极反应式为$ CH_4 + 10 OH^- - 8 e^- \xlongequal{} CO_3^{2-} + 7 H_2 O$。
问题4 提示:不同,相反应式是甲烷燃烧的化学方程式$ CH_4 + 2 O_2 \xlongequal{} CO_2 + 2 H_2 O$,其中正极反应式为$2 O_2 + 8 H^+ + 8 e^- \xlongequal{} 4 H_2 O$,负极反应式为$ CH_4 - 8 e^- + 2 H_2 O \xlongequal{} CO_2 + 8 H^+$。
查看更多完整答案,请扫码查看


