第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
1.酸碱反应。
(1)碱与酸反应生成盐和水。
$NaOH + HCl \xlongequal{} $
$2NaOH + H_2SO_4 \xlongequal{} $
现象:
判断酸和碱是否发生了反应的方法:
(2)酸与碱之间发生反应的实质。
酸中的
2.酸碱反应的应用。
(1)改良土壤的酸碱性:农业上用
(2)处理工厂的废水:用
(3)精炼石油:用
(4)中和胃酸:医学上用
(1)碱与酸反应生成盐和水。
$NaOH + HCl \xlongequal{} $
NaCl+H₂O
$2NaOH + H_2SO_4 \xlongequal{} $
Na₂SO₄+2H₂O
现象:
无明显现象
。判断酸和碱是否发生了反应的方法:
加入酸碱指示剂
。(2)酸与碱之间发生反应的实质。
酸中的
H⁺
和碱中的OH⁻
发生作用生成水
的过程,即$H^+ + OH^- \xlongequal{} H_2O$。2.酸碱反应的应用。
(1)改良土壤的酸碱性:农业上用
熟石灰
降低土壤的酸性。(2)处理工厂的废水:用
熟石灰
处理酸性的工业废水。(3)精炼石油:用
氢氧化钠
来除去过量的酸。(4)中和胃酸:医学上用
氢氧化铝
除去过多的胃酸。
答案:
1.
(1)NaCl+H₂O Na₂SO₄+2H₂O 无明显现象 加入酸碱指示剂
(2)H⁺ OH⁻ 水
2.
(1)熟石灰
(2)熟石灰
(3)氢氧化钠
(4)氢氧化铝
(1)NaCl+H₂O Na₂SO₄+2H₂O 无明显现象 加入酸碱指示剂
(2)H⁺ OH⁻ 水
2.
(1)熟石灰
(2)熟石灰
(3)氢氧化钠
(4)氢氧化铝
1.右下图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是(
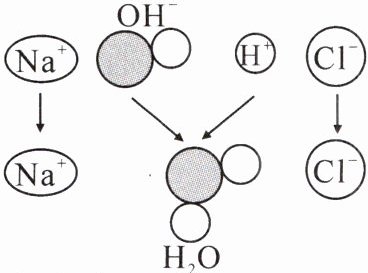
A.反应后溶液的pH大于7
B.反应前两种溶液均能导电,反应后的溶液不能导电
C.反应后溶液中的粒子只有$Na^+$和$Cl^-$
D.向反应后所得溶液中滴入几滴酚酞试液,溶液呈无色
D
)
A.反应后溶液的pH大于7
B.反应前两种溶液均能导电,反应后的溶液不能导电
C.反应后溶液中的粒子只有$Na^+$和$Cl^-$
D.向反应后所得溶液中滴入几滴酚酞试液,溶液呈无色
答案:
1.D
2.室温时,向盛有稀硫酸的烧杯中逐滴加入$Ba(OH)_2$溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化),下列分析正确的是(

A.a点溶液中有两种溶质
B.向b点溶液中滴加紫色石蕊试液,溶液变蓝
C.c点烧杯内液体的pH=7
D.d点溶液中有较多的$Ba^{2+}$、$OH^-$、$SO_4^{2-}$、$H^+$
C
)
A.a点溶液中有两种溶质
B.向b点溶液中滴加紫色石蕊试液,溶液变蓝
C.c点烧杯内液体的pH=7
D.d点溶液中有较多的$Ba^{2+}$、$OH^-$、$SO_4^{2-}$、$H^+$
答案:
2.C
查看更多完整答案,请扫码查看


