第19页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
6. 将 4.0 g Cu - Zn 合金粉末放入盛有 10 g 稀硫酸的烧杯中,恰好完全反应。过滤,称量滤液的质量,相关实验数据如表所示。
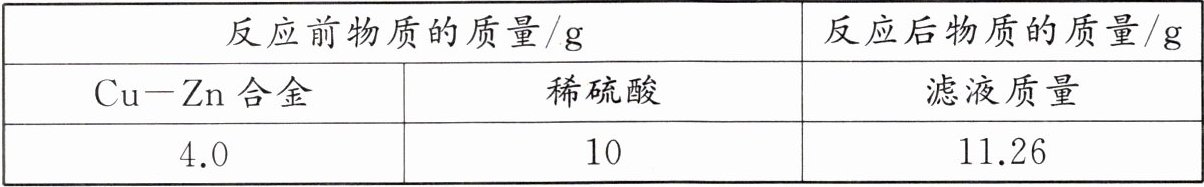
(1) Cu - Zn 合金属于
(2) 请计算该 Cu - Zn 合金中 Zn 的质量分数。

(1) Cu - Zn 合金属于
金属
材料。(2) 请计算该 Cu - Zn 合金中 Zn 的质量分数。
答案:
6.
(1)金属
(2)解:设 4.0 g Cu-Zn 合金中 Zn 的质量为 x。
Zn+H₂SO₄=ZnSO₄+H₂↑ 溶液质量变化
65 98 161 161-98=63
x 11.26 g-10 g=1.26 g
$\frac{65}{63}=\frac{x}{1.26 g}$
x=1.3 g
则 Cu-Zn 合金中 Zn 的质量分数为$\frac{1.3 g}{4.0 g}×$
100%=32.5%。
答:该 Cu-Zn 合金中 Zn 的质量分数是 32.5%。
(1)金属
(2)解:设 4.0 g Cu-Zn 合金中 Zn 的质量为 x。
Zn+H₂SO₄=ZnSO₄+H₂↑ 溶液质量变化
65 98 161 161-98=63
x 11.26 g-10 g=1.26 g
$\frac{65}{63}=\frac{x}{1.26 g}$
x=1.3 g
则 Cu-Zn 合金中 Zn 的质量分数为$\frac{1.3 g}{4.0 g}×$
100%=32.5%。
答:该 Cu-Zn 合金中 Zn 的质量分数是 32.5%。
7. 金属的应用与其性质密切相关。在“金属与盐溶液反应”的探究课上,同学们将硝酸银溶液倒入装有铜粉的试管中,充分反应后观察到铜粉表面析出银白色物质以及
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】猜想一:硝酸铜。
猜想二:

【解释与结论】根据对滤液成分的分析,可以推断出滤渣的可能成分是
① 铜 ② 银 ③ 铜和银
【拓展与延伸】对滤渣回收后,老师要求将滤液中较多的铜离子除去后再排放,以减少对环境的污染。同学们可以向滤液中加入适量的
① 铁 ② 稀硫酸 ③ 氢氧化钠溶液 ④ 氯化钠溶液
溶液由无色变成蓝色
,发生反应的化学方程式为:Cu+2AgNO₃=Cu(NO₃)₂+2Ag
。过滤后,得到滤渣和滤液。同学们进行了以下探究。【提出问题】滤液中溶质的成分是什么?
【猜想与假设】猜想一:硝酸铜。
猜想二:
硝酸银和硝酸铜
。
【解释与结论】根据对滤液成分的分析,可以推断出滤渣的可能成分是
②③
(填序号)。① 铜 ② 银 ③ 铜和银
【拓展与延伸】对滤渣回收后,老师要求将滤液中较多的铜离子除去后再排放,以减少对环境的污染。同学们可以向滤液中加入适量的
①③
(填序号)。① 铁 ② 稀硫酸 ③ 氢氧化钠溶液 ④ 氯化钠溶液
答案:
7.溶液由无色变成蓝色 Cu+2AgNO₃=
Cu(NO₃)₂+2Ag 硝酸银和硝酸铜 无明显现象 ②③ ①③
Cu(NO₃)₂+2Ag 硝酸银和硝酸铜 无明显现象 ②③ ①③
查看更多完整答案,请扫码查看


