2025年初中升高中衔接读本化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年初中升高中衔接读本化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第54页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
例2 (全国高考)过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
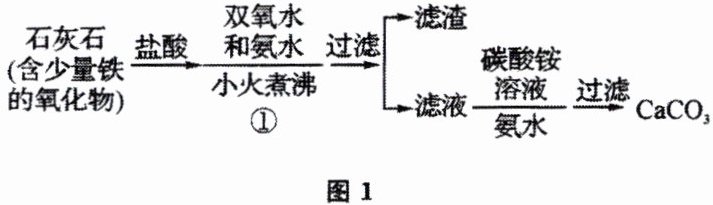
(1)步骤①加入氨水的目的是______。小火煮沸的作用是使沉淀颗粒长大,有利于______。
(2)图2是某学生的过滤操作示意图,其操作不规范的是______(填字母)。

a. 漏斗末端颈尖未紧靠烧杯壁
b. 玻璃棒用作引流
c. 将滤纸湿润,使其紧贴漏斗壁
d. 滤纸边缘高出漏斗
e. 用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
${CaCO3 ->[稀盐酸、煮沸、过滤][②] 滤液 ->[氨水和双氧水][冰浴③] 过滤 -> 白色晶体}$
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈______(填“酸”“碱”或“中”)性。将溶液煮沸,趁热过滤,将溶液煮沸的作用是______。
(4)步骤③中反应的化学方程式为______,该反应需要在冰浴下进行,原因是______。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是______。
(6)制备过氧化钙的另一种方法是将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,缺点是______。
【分析】(一)碳酸钙的制备 由流程可知加盐酸后,碳酸钙、铁的氧化物均溶解,加双氧水可氧化亚铁离子,加氨水将铁离子转化为沉淀,过滤后的溶液含有氯化钙,加碳酸铵在碱性条件下反应得碳酸钙。
(1)反应中盐酸过量,且溶液中含有铁离子,因此步骤①加入氨水的目的是中和多余的盐酸,沉淀铁离子;小火煮沸的作用是使沉淀颗粒长大,有利于过滤。
(2)过滤时漏斗末端颈尖应该紧靠烧杯壁,a错误;玻璃棒用作引流,b正确;将滤纸湿润,使其紧贴漏斗壁,防止有气泡,c正确;滤纸边缘应该低于漏斗,d错误;用玻璃棒在漏斗中轻轻搅动容易弄破滤纸,e错误。
(二)过氧化钙的制备 由流程可知碳酸钙溶于盐酸至溶液中尚存有少量固体,过滤,滤液中氯化钙与氨水、过氧化氢反应生成过氧化钙、氯化铵和水,再过滤,洗涤得到过氧化钙。
(3)溶液此时溶解了生成的二氧化碳,呈酸性;将溶液煮沸的目的是除去溶解在溶液中的二氧化碳。
(4)步骤③中反应的化学方程式为${CaCl2 + 2NH3 \cdot H2O + H2O2 = CaO2 \downarrow + 2NH4Cl + 2H2O}$,在冰浴下进行是为了防止温度过高导致双氧水分解。
(5)使用乙醇洗涤的目的是减少${CaO2}$的溶解而导致最终产物量的减少。
(6)该方法的优点是原料来源丰富、操作简单,缺点是能源消耗大,产品纯度较低。
【解答】(1)中和多余的盐酸,沉淀铁离子 过滤 (2)ade (3)酸 除去溶液中溶解的${CO2}$ (4)${CaCl2 + 2NH3 \cdot H2O + H2O2 = CaO2 \downarrow + 2NH4Cl + 2H2O}$ 防止过氧化氢分解 (5)减少${CaO2}$溶解 (6)原料来源丰富、操作简单 煅烧石灰石需要消耗大量的能量,得到的产品纯度低
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是______。小火煮沸的作用是使沉淀颗粒长大,有利于______。
(2)图2是某学生的过滤操作示意图,其操作不规范的是______(填字母)。

a. 漏斗末端颈尖未紧靠烧杯壁
b. 玻璃棒用作引流
c. 将滤纸湿润,使其紧贴漏斗壁
d. 滤纸边缘高出漏斗
e. 用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
${CaCO3 ->[稀盐酸、煮沸、过滤][②] 滤液 ->[氨水和双氧水][冰浴③] 过滤 -> 白色晶体}$
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈______(填“酸”“碱”或“中”)性。将溶液煮沸,趁热过滤,将溶液煮沸的作用是______。
(4)步骤③中反应的化学方程式为______,该反应需要在冰浴下进行,原因是______。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是______。
(6)制备过氧化钙的另一种方法是将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,缺点是______。
【分析】(一)碳酸钙的制备 由流程可知加盐酸后,碳酸钙、铁的氧化物均溶解,加双氧水可氧化亚铁离子,加氨水将铁离子转化为沉淀,过滤后的溶液含有氯化钙,加碳酸铵在碱性条件下反应得碳酸钙。
(1)反应中盐酸过量,且溶液中含有铁离子,因此步骤①加入氨水的目的是中和多余的盐酸,沉淀铁离子;小火煮沸的作用是使沉淀颗粒长大,有利于过滤。
(2)过滤时漏斗末端颈尖应该紧靠烧杯壁,a错误;玻璃棒用作引流,b正确;将滤纸湿润,使其紧贴漏斗壁,防止有气泡,c正确;滤纸边缘应该低于漏斗,d错误;用玻璃棒在漏斗中轻轻搅动容易弄破滤纸,e错误。
(二)过氧化钙的制备 由流程可知碳酸钙溶于盐酸至溶液中尚存有少量固体,过滤,滤液中氯化钙与氨水、过氧化氢反应生成过氧化钙、氯化铵和水,再过滤,洗涤得到过氧化钙。
(3)溶液此时溶解了生成的二氧化碳,呈酸性;将溶液煮沸的目的是除去溶解在溶液中的二氧化碳。
(4)步骤③中反应的化学方程式为${CaCl2 + 2NH3 \cdot H2O + H2O2 = CaO2 \downarrow + 2NH4Cl + 2H2O}$,在冰浴下进行是为了防止温度过高导致双氧水分解。
(5)使用乙醇洗涤的目的是减少${CaO2}$的溶解而导致最终产物量的减少。
(6)该方法的优点是原料来源丰富、操作简单,缺点是能源消耗大,产品纯度较低。
【解答】(1)中和多余的盐酸,沉淀铁离子 过滤 (2)ade (3)酸 除去溶液中溶解的${CO2}$ (4)${CaCl2 + 2NH3 \cdot H2O + H2O2 = CaO2 \downarrow + 2NH4Cl + 2H2O}$ 防止过氧化氢分解 (5)减少${CaO2}$溶解 (6)原料来源丰富、操作简单 煅烧石灰石需要消耗大量的能量,得到的产品纯度低
答案:
(1)中和多余的盐酸,沉淀铁离子;过滤
(2)ade
(3)酸;除去溶液中溶解的CO₂
(4)CaCl₂ + 2NH₃·H₂O + H₂O₂ = CaO₂↓ + 2NH₄Cl + 2H₂O;防止过氧化氢分解
(5)减少CaO₂溶解
(6)原料来源丰富、操作简单;煅烧石灰石需要消耗大量的能量,得到的产品纯度低
(2)ade
(3)酸;除去溶液中溶解的CO₂
(4)CaCl₂ + 2NH₃·H₂O + H₂O₂ = CaO₂↓ + 2NH₄Cl + 2H₂O;防止过氧化氢分解
(5)减少CaO₂溶解
(6)原料来源丰富、操作简单;煅烧石灰石需要消耗大量的能量,得到的产品纯度低
查看更多完整答案,请扫码查看


