第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
9. 下列过程导致的溶液导电能力的变化与图像相符的是(
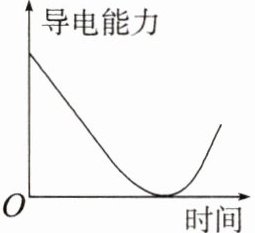
A. 向饱和石灰水中持续通入$CO_2$
B. 向饱和$CuSO_4$溶液中加入$CuSO_4$固体
C. 向$CH_3COONa$溶液中加入$NaOH$固体
D. 向$Na_2SO_4$溶液中加入$Ba(OH)_2$固体
A
)
A. 向饱和石灰水中持续通入$CO_2$
B. 向饱和$CuSO_4$溶液中加入$CuSO_4$固体
C. 向$CH_3COONa$溶液中加入$NaOH$固体
D. 向$Na_2SO_4$溶液中加入$Ba(OH)_2$固体
答案:
9.A 向饱和石灰水中持续通入$CO_{2}$,先生成$CaCO_{3}$沉淀,使溶液的导电能力逐渐减弱至降为0;继续通入$CO_{2}$,$CaCO_{3}$与$H_{2}O$和$CO_{2}$反应生成可溶于水的$Ca(HCO_{3})_{2}$,溶液中离子浓度增大,使溶液的导电能力增强,与图中变化相符,A符合题意。向饱和$CuSO_{4}$溶液中加入$CuSO_{4}$固体,溶液中离子的浓度基本不变,导电能力不变,B不符合题意。向$CH_{3}COONa$溶液中加入NaOH固体,溶液中离子的浓度增大,则溶液的导电能力增强,C不符合题意。向$Na_{2}SO_{4}$溶液中加入$Ba(OH)_{2}$溶液,发生反应生成$BaSO_{4}$沉淀和NaOH,溶液中离子浓度减小,但溶液中始终存在离子,导电能力不为0,D不符合题意。
【方法技巧】对于导电能力一时间/导电能力一溶液体积等图像题,首先看图像的横、纵坐标表示的物理量;其次看“两点”:起点、拐点。起点可表示原始溶液中电解质的情况,若起点时导电能力较差,可能为弱电解质溶液;若起点时导电能力较好,可能为强电解质溶液等。拐点表示变化的点,若拐点出现时是导电能力由大变小再变大,则可能为强电解质发生反应变为弱电解质(或沉淀),反应完全后继续加入强电解质(或沉淀溶解)。
【方法技巧】对于导电能力一时间/导电能力一溶液体积等图像题,首先看图像的横、纵坐标表示的物理量;其次看“两点”:起点、拐点。起点可表示原始溶液中电解质的情况,若起点时导电能力较差,可能为弱电解质溶液;若起点时导电能力较好,可能为强电解质溶液等。拐点表示变化的点,若拐点出现时是导电能力由大变小再变大,则可能为强电解质发生反应变为弱电解质(或沉淀),反应完全后继续加入强电解质(或沉淀溶解)。
10. 下列各组溶液,只需让组内物质相互反应就能区别开来的是(
A. $NaOH$、$Na_2CO_3$、$NaCl$、$HNO_3$
B. $BaCl_2$、$Na_2CO_3$、$KOH$、$K_2SO_4$
C. $Ba(OH)_2$、$Na_2SO_4$、$MgCl_2$、$HCl$
D. $H_2SO_4$、$KCl$、$ZnCl_2$、$CuCl_2$
C
)A. $NaOH$、$Na_2CO_3$、$NaCl$、$HNO_3$
B. $BaCl_2$、$Na_2CO_3$、$KOH$、$K_2SO_4$
C. $Ba(OH)_2$、$Na_2SO_4$、$MgCl_2$、$HCl$
D. $H_2SO_4$、$KCl$、$ZnCl_2$、$CuCl_2$
答案:
10.C $Na_{2}CO_{3}$和$HNO_{3}$反应会产生气体,其余物质两两混合后无明显现象,无法区别开来,A不符合题意;$K_{2}SO_{4}$和$Na_{2}CO_{3}$均能与$BaCl_{2}$反应生成白色沉淀,无法区别开来,B不符合题意;$Ba(OH)_{2}$和$Na_{2}SO_{4}$能反应生成白色沉淀,加入盐酸白色沉淀不溶解,$Ba(OH)_{2}$能和$MgCl_{2}$反应生成白色沉淀,加入盐酸白色沉淀溶解,可以相互反应区别开来,C符合题意;通过溶液颜色可以辨认出$CuCl_{2}$,其余物质两两混合后无明显现象,无法区别开来,D不符合题意。
11. 将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:$K^+$、$Mg^{2+}$、$Fe^{3+}$、$Ba^{2+}$、$SO_4^{2-}$、$OH^-$、$CO_3^{2-}$和$Cl^-$。取该溶液进行如下实验:
Ⅰ. 取少量溶液滴入紫色石蕊溶液后显蓝色。
Ⅱ. 取少许原溶液滴入$BaCl_2$溶液,无白色沉淀产生。
Ⅲ. 另取少许原溶液先滴加稀硝酸再滴加$AgNO_3$溶液,产生白色沉淀。
Ⅳ. 再取少许原溶液滴入少量$H_2SO_4$溶液,有白色沉淀产生。
请回答下列问题:
(1)原溶液中肯定不存在的离子是
(2)写出实验Ⅲ中产生白色沉淀的离子方程式:
(3)写出实验Ⅳ中产生白色沉淀的离子方程式:
(4)若溶液中各离子的个数相等,则溶液中
Ⅰ. 取少量溶液滴入紫色石蕊溶液后显蓝色。
Ⅱ. 取少许原溶液滴入$BaCl_2$溶液,无白色沉淀产生。
Ⅲ. 另取少许原溶液先滴加稀硝酸再滴加$AgNO_3$溶液,产生白色沉淀。
Ⅳ. 再取少许原溶液滴入少量$H_2SO_4$溶液,有白色沉淀产生。
请回答下列问题:
(1)原溶液中肯定不存在的离子是
$Mg^{2+}$、$Fe^{3+}$、$SO_4^{2-}$、$CO_3^{2-}$
;肯定存在的离子是$Ba^{2+}$、$OH^-$、$Cl^-$
。(2)写出实验Ⅲ中产生白色沉淀的离子方程式:
$Ag^++Cl^-=AgCl\downarrow$
。(3)写出实验Ⅳ中产生白色沉淀的离子方程式:
$Ba^{2+}+SO_4^{2-}=BaSO_4\downarrow$
。(4)若溶液中各离子的个数相等,则溶液中
无
(填“有”或“无”)$K^+$,判断依据是根据溶液呈电中性,相同个数的$Ba^{2+}$、$Cl^-$和$OH^-$已经能保证溶液呈电中性,若再有$K^+$,则溶液不再呈电中性,所以没有$K^+$
(3分)。
答案:
11.
(1)$Mg^{2+}$、$Fe^{3+}$、$SO_{4}^{2-}$、$CO_{3}^{2-}$ $Ba^{2+}$、$OH^{-}$、$Cl^{-}$
(2)$Ag^{+}+Cl^{-}=AgCl\downarrow$
(3)$Ba^{2+}+SO_{4}^{2-}=BaSO_{4}\downarrow$
(4)无 根据溶液呈电中性,相同个数的$Ba^{2+}$、$Cl^{-}$和$OH^{-}$已经能保证溶液呈电中性,若再有$K^{+}$,则溶液不再呈电中性,所以没有$K^{+}$
【解析】
(1)溶液呈无色,所以不存在$Fe^{3+}$;滴入紫色石蕊溶液显蓝色,说明溶液呈碱性,则有$OH^{-}$,则原溶液中不存在能和$OH^{-}$反应的$Mg^{2+}$;向原溶液中滴入$BaCl_{2}$溶液,无白色沉淀产生,说明不存在$SO_{4}^{2-}$和$CO_{3}^{2-}$;向原溶液中先滴加稀硝酸再滴加$AgNO_{3}$溶液,产生白色沉淀,说明原溶液中存在$Cl^{-}$;向原溶液滴入少量$H_{2}SO_{4}$溶液,有白色沉淀产生,说明存在$Ba^{2+}$。综上所述,原溶液中肯定不存在的离子是$Mg^{2+}$、$Fe^{3+}$、$SO_{4}^{2-}$、$CO_{3}^{2-}$,肯定存在的离子是$Ba^{2+}$、$OH^{-}$、$Cl^{-}$。
(2)实验Ⅲ中先加稀硝酸,中和了$OH^{-}$,再加硝酸银溶液,银离子和氯离子反应产生AgCl白色沉淀。
(1)$Mg^{2+}$、$Fe^{3+}$、$SO_{4}^{2-}$、$CO_{3}^{2-}$ $Ba^{2+}$、$OH^{-}$、$Cl^{-}$
(2)$Ag^{+}+Cl^{-}=AgCl\downarrow$
(3)$Ba^{2+}+SO_{4}^{2-}=BaSO_{4}\downarrow$
(4)无 根据溶液呈电中性,相同个数的$Ba^{2+}$、$Cl^{-}$和$OH^{-}$已经能保证溶液呈电中性,若再有$K^{+}$,则溶液不再呈电中性,所以没有$K^{+}$
【解析】
(1)溶液呈无色,所以不存在$Fe^{3+}$;滴入紫色石蕊溶液显蓝色,说明溶液呈碱性,则有$OH^{-}$,则原溶液中不存在能和$OH^{-}$反应的$Mg^{2+}$;向原溶液中滴入$BaCl_{2}$溶液,无白色沉淀产生,说明不存在$SO_{4}^{2-}$和$CO_{3}^{2-}$;向原溶液中先滴加稀硝酸再滴加$AgNO_{3}$溶液,产生白色沉淀,说明原溶液中存在$Cl^{-}$;向原溶液滴入少量$H_{2}SO_{4}$溶液,有白色沉淀产生,说明存在$Ba^{2+}$。综上所述,原溶液中肯定不存在的离子是$Mg^{2+}$、$Fe^{3+}$、$SO_{4}^{2-}$、$CO_{3}^{2-}$,肯定存在的离子是$Ba^{2+}$、$OH^{-}$、$Cl^{-}$。
(2)实验Ⅲ中先加稀硝酸,中和了$OH^{-}$,再加硝酸银溶液,银离子和氯离子反应产生AgCl白色沉淀。
12. 氯化钠既是我们日常生活中不可缺少的调味品,也是一种重要的化工原料。某化学兴趣小组进行粗盐(主要含有泥沙、$Na^+$、$Ca^{2+}$、$Mg^{2+}$、$SO_4^{2-}$、$Cl^-$)提纯实验。
Ⅰ. 甲同学的操作步骤如图所示:
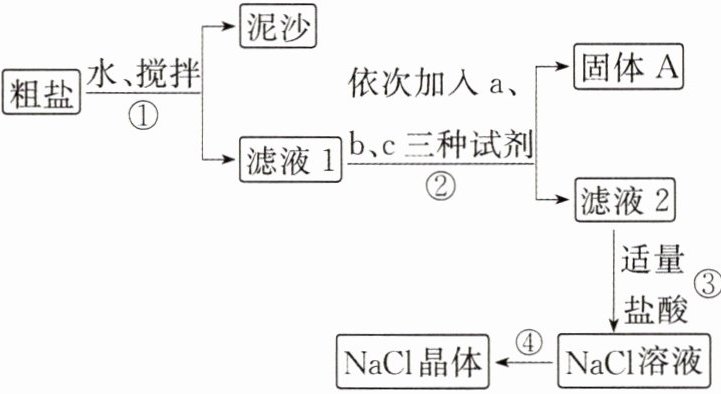
已知:$BaSO_4$不溶于稀盐酸和稀硝酸。
依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、
(2)从产品纯度考虑,试剂$a$、$b$、$c$可以分别为
A. $BaCl_2$溶液、$NaOH$溶液、$Na_2SO_4$溶液
B. $NaOH$溶液、$BaCl_2$溶液、$Na_2CO_3$溶液
C. $BaCl_2$溶液、$Na_2SO_4$溶液、$NaOH$溶液
(3)加入盐酸时生成$CO_2$的反应的离子方程式为
Ⅱ. 乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
|猜想|验证的方法|现象|结论|
|----|----|----|----|
|猜想1:固体$A$中含$BaCO_3$|取少量固体$A$于试管中,先加入足量
|猜想2:最后制得的$NaCl$晶体中还含有$Na_2SO_4$|取少量提纯后的$NaCl$晶体于试管中,加入适量的蒸馏水溶解,滴入稀硝酸和$BaCl_2$溶液|
(4)完成上述表格(可供选择的试剂:稀盐酸、$Na_2SO_4$溶液、$BaCl_2$溶液)。
(5)根据乙同学的实验,请对甲同学的实验设计进行评价:
Ⅰ. 甲同学的操作步骤如图所示:

已知:$BaSO_4$不溶于稀盐酸和稀硝酸。
依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、
漏斗、玻璃棒
。(2)从产品纯度考虑,试剂$a$、$b$、$c$可以分别为
B
(填字母)。A. $BaCl_2$溶液、$NaOH$溶液、$Na_2SO_4$溶液
B. $NaOH$溶液、$BaCl_2$溶液、$Na_2CO_3$溶液
C. $BaCl_2$溶液、$Na_2SO_4$溶液、$NaOH$溶液
(3)加入盐酸时生成$CO_2$的反应的离子方程式为
$2H^{+}+CO_{3}^{2-}=CO_{2}\uparrow +H_{2}O$
。Ⅱ. 乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
|猜想|验证的方法|现象|结论|
|----|----|----|----|
|猜想1:固体$A$中含$BaCO_3$|取少量固体$A$于试管中,先加入足量
稀盐酸
,再加入$Na_2SO_4$溶液
|有气泡产生,无白色沉淀|猜想1不成立
||猜想2:最后制得的$NaCl$晶体中还含有$Na_2SO_4$|取少量提纯后的$NaCl$晶体于试管中,加入适量的蒸馏水溶解,滴入稀硝酸和$BaCl_2$溶液|
有白色沉淀生成
|猜想2成立|(4)完成上述表格(可供选择的试剂:稀盐酸、$Na_2SO_4$溶液、$BaCl_2$溶液)。
(5)根据乙同学的实验,请对甲同学的实验设计进行评价:
甲同学制得的NaCl晶体不纯,其中含有$SO_{4}^{2-}$
。
答案:
12.
(1)漏斗、玻璃棒
(2)B
(3)$2H^{+}+CO_{3}^{2-}=CO_{2}\uparrow +H_{2}O$
(4)稀盐酸 $Na_{2}SO_{4}$溶液 猜想1不成立 有白色沉淀生成
(5)甲同学制得的NaCl晶体不纯,其中含有$SO_{4}^{2-}$
【解析】粗盐溶解后过滤可除去难溶性泥沙。向滤液1中加入NaOH溶液可除去$Mg^{2+}$,加入$BaCl_{2}$溶液可除去$SO_{4}^{2-}$,加入$Na_{2}CO_{3}$溶液可除去$Ca^{2+}$和过量的$Ba^{2+}$,故必须先加$BaCl_{2}$溶液再加$Na_{2}CO_{3}$溶液,过滤分离出固体A。向滤液2中加入盐酸可除去过量的NaOH和$Na_{2}CO_{3}$,蒸发结晶得到氯化钠晶体。
(1)操作①为过滤,过滤所用的玻璃仪器包括烧杯、漏斗、玻璃棒。
(4)猜想1为固体A中含$BaCO_{3}$,$BaCO_{3}$能溶于稀盐酸,反应生成二氧化碳气体和氯化钡,氯化钡能和硫酸钠反应生成硫酸钡沉淀,现象为有气泡产生,无白色沉淀,则A中不含$BaCO_{3}$,猜想1错误;猜想2为最后制得的NaCl晶体中还含有$Na_{2}SO_{4}$,且猜想成立,$Na_{2}SO_{4}$和$BaCl_{2}$能反应生成不溶于酸的$BaSO_{4}$沉淀,则取少量提纯后的NaCl晶体于试管中,加入适量的蒸馏水溶解,滴入稀硝酸和$BaCl_{2}$溶液,现象为有白色沉淀生成。
(1)漏斗、玻璃棒
(2)B
(3)$2H^{+}+CO_{3}^{2-}=CO_{2}\uparrow +H_{2}O$
(4)稀盐酸 $Na_{2}SO_{4}$溶液 猜想1不成立 有白色沉淀生成
(5)甲同学制得的NaCl晶体不纯,其中含有$SO_{4}^{2-}$
【解析】粗盐溶解后过滤可除去难溶性泥沙。向滤液1中加入NaOH溶液可除去$Mg^{2+}$,加入$BaCl_{2}$溶液可除去$SO_{4}^{2-}$,加入$Na_{2}CO_{3}$溶液可除去$Ca^{2+}$和过量的$Ba^{2+}$,故必须先加$BaCl_{2}$溶液再加$Na_{2}CO_{3}$溶液,过滤分离出固体A。向滤液2中加入盐酸可除去过量的NaOH和$Na_{2}CO_{3}$,蒸发结晶得到氯化钠晶体。
(1)操作①为过滤,过滤所用的玻璃仪器包括烧杯、漏斗、玻璃棒。
(4)猜想1为固体A中含$BaCO_{3}$,$BaCO_{3}$能溶于稀盐酸,反应生成二氧化碳气体和氯化钡,氯化钡能和硫酸钠反应生成硫酸钡沉淀,现象为有气泡产生,无白色沉淀,则A中不含$BaCO_{3}$,猜想1错误;猜想2为最后制得的NaCl晶体中还含有$Na_{2}SO_{4}$,且猜想成立,$Na_{2}SO_{4}$和$BaCl_{2}$能反应生成不溶于酸的$BaSO_{4}$沉淀,则取少量提纯后的NaCl晶体于试管中,加入适量的蒸馏水溶解,滴入稀硝酸和$BaCl_{2}$溶液,现象为有白色沉淀生成。
查看更多完整答案,请扫码查看


