第127页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
【变式】NaClO₂是一种重要的杀菌消毒剂,制备NaClO₂的一种生产工艺流程如图所示。下列说法错误的是 (
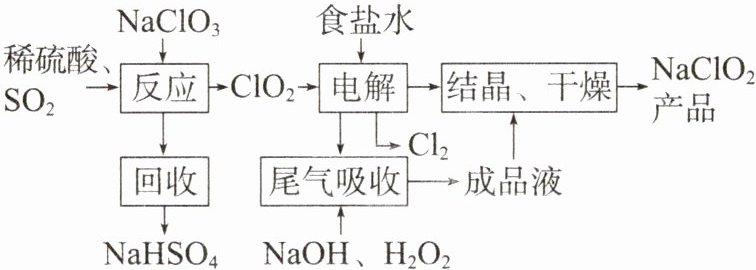
A.该生产过程中,有三处涉及氧化还原反应
B.“电解”过程中,NaClO₂是还原产物
C.“尾气吸收”过程中,氧化剂与还原剂的个数之比为1:2
D.“电解”过程中,每反应5个ClO₂转移5个电子
C
)
A.该生产过程中,有三处涉及氧化还原反应
B.“电解”过程中,NaClO₂是还原产物
C.“尾气吸收”过程中,氧化剂与还原剂的个数之比为1:2
D.“电解”过程中,每反应5个ClO₂转移5个电子
答案:
C 由制备流程可知,$NaClO_{3}$和$SO_{2}$在$H_{2}SO_{4}$酸化条件下生成$ClO_{2}$,其中$NaClO_{3}$是氧化剂,回收产物为$NaHSO_{4}$,说明反应生成$NaHSO_{4}$和$ClO_{2}$,反应的化学方程式为$2NaClO_{3}+SO_{2}+H_{2}SO_{4}=2NaHSO_{4}+2ClO_{2}$;根据进、出箭头方向,判断电解装置中食盐水与$ClO_{2}$反应生成$NaClO_{2}$和$Cl_{2}$,含过氧化氢的氢氧化钠溶液吸收尾气中的部分$ClO_{2}$,再得到产物$NaClO_{2}$,最后$NaClO_{2}$溶液结晶、干燥得到产品。由制备流程可知,“反应”“电解”“尾气吸收”过程中氯元素的化合价均发生变化,发生了氧化还原反应,A 正确;“电解”过程中,反应的关系式为$2ClO_{2}\sim 2NaCl\sim 2e^{-}\sim Cl_{2}\sim 2NaClO_{2}$,$ClO_{2}$发生还原反应生成$NaClO_{2}$,$NaClO_{2}$是还原产物,B 正确;“尾气吸收”过程发生反应的化学方程式为$2ClO_{2}+H_{2}O_{2}+2NaOH=2NaClO_{2}+O_{2}+2H_{2}O$,该反应中$H_{2}O_{2}$中 O 元素的化合价由 -1 变为 0、Cl 元素的化合价由 +4 变为 +3,$ClO_{2}$是氧化剂、$H_{2}O_{2}$是还原剂,氧化剂与还原剂的物质的量之比等于其计量数之比,即$2:1$,C 错误;“电解”过程中存在关系式$2ClO_{2}\sim 2e^{-}$,因此,每反应 5 个$ClO_{2}$转移 5 个电子,D 正确。
1.利用浓缩海水,模拟侯氏制碱法制备NaHCO₃,进一步处理得到产品Na₂CO₃和NH₄Cl,实验流程如图所示。
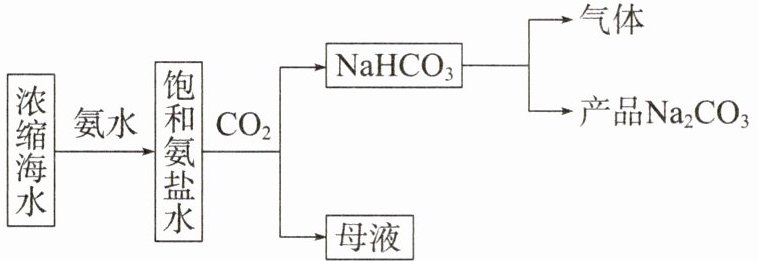
下列说法错误的是 (
A.将饱和氨盐水雾化后与CO₂反应可使反应更快更充分
B.制备NaHCO₃的化学方程式为NH₃ + NaCl + H₂O + CO₂ = NaHCO₃↓ + NH₄Cl
C.流程中“气体”可循环利用
D.将“母液”低温蒸发结晶可得纯净的NH₄Cl

下列说法错误的是 (
D
)A.将饱和氨盐水雾化后与CO₂反应可使反应更快更充分
B.制备NaHCO₃的化学方程式为NH₃ + NaCl + H₂O + CO₂ = NaHCO₃↓ + NH₄Cl
C.流程中“气体”可循环利用
D.将“母液”低温蒸发结晶可得纯净的NH₄Cl
答案:
D 将饱和氨盐水雾化后,再通入$CO_{2}$发生反应可增大反应物的接触面积,从而使反应更快更充分,提高产率,A 正确;制备$NaHCO_{3}$时,将$CO_{2}$通入饱和氨盐水中,发生反应生成$NaHCO_{3}$沉淀和$NH_{4}Cl$,化学方程式为$NH_{3}+NaCl+H_{2}O+CO_{2}=NaHCO_{3}\downarrow +NH_{4}Cl$,B 正确;流程中“气体”为$CO_{2}$,可循环利用,C 正确;“母液”中含有$NH_{4}Cl$、$NaCl$、$NaHCO_{3}$等,将“母液”低温蒸发结晶,得到的是混合物,D 错误。
2.烟气中的SO₂易造成酸雨,一种烟气脱硫技术如图所示,下列说法错误的是 (
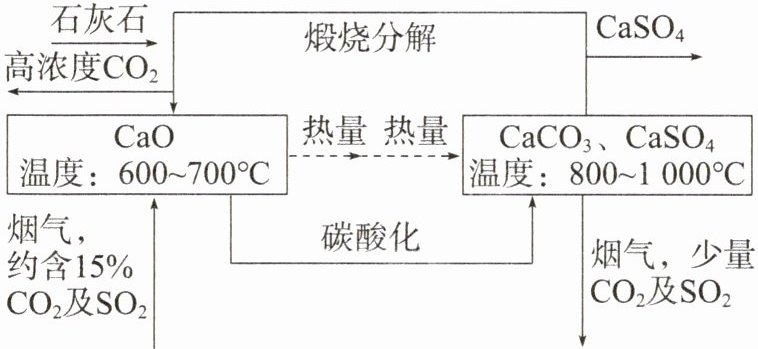
A.图中涉及了分解反应、化合反应、置换反应和复分解反应
B.“碳酸化”过程中,二氧化硫发生了氧化反应
C.“煅烧分解”的化学方程式为CaCO₃ $\xlongequal{高温}$ CaO + CO₂↑
D.CO₂为酸性氧化物,与CO不互为同素异形体
A
)
A.图中涉及了分解反应、化合反应、置换反应和复分解反应
B.“碳酸化”过程中,二氧化硫发生了氧化反应
C.“煅烧分解”的化学方程式为CaCO₃ $\xlongequal{高温}$ CaO + CO₂↑
D.CO₂为酸性氧化物,与CO不互为同素异形体
答案:
A “煅烧分解”过程发生反应$CaCO_{3}\xlongequal{高温}CaO+CO_{2}\uparrow$,为分解反应;“碳酸化”过程发生反应$CaCO_{3}+SO_{2}\xlongequal{高温}CaSO_{3}+CO_{2}$,不属于四种基本类型的反应,$2CaSO_{3}+O_{2}\xlongequal{高温}2CaSO_{4}$,为化合反应,也是氧化还原反应,图中没有涉及置换反应和复分解反应,A 错误,C 正确;由题图可知,“碳酸化”过程中$SO_{2}$转化为$CaSO_{4}$,S 元素化合价升高,$SO_{2}$发生了氧化反应,B 正确;$CO_{2}$为酸性氧化物,$CO_{2}$和 CO 都不是单质,不互为同素异形体,D 正确。
3.物以“硒”为贵,人倚“硒”为福。硒在医学健康、电子、化工、农业等领域应用广泛。工业上也常用硫酸化焙烧法提取硒,含硒阳极泥中的硒元素主要以硒和硒化亚铜(Cu₂Se)的形式存在,含硒阳极泥提取硒的工艺提取流程如图所示:
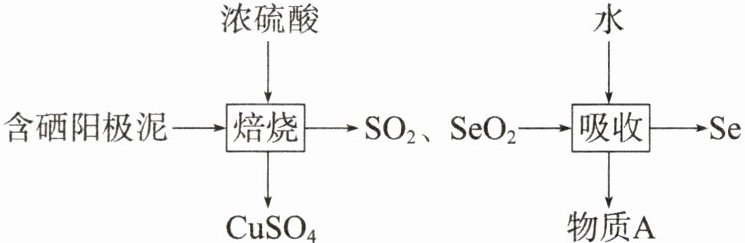
(1)已知SeO₂是一种酸性氧化物,若用足量的NaOH溶液吸收烟气中的SeO₂,反应生成一种盐,该盐的化学式为________
(2)整个工艺流程中可以循环利用的物质为________
(3)Cu₂Se与浓硫酸反应的化学方程式为________

(1)已知SeO₂是一种酸性氧化物,若用足量的NaOH溶液吸收烟气中的SeO₂,反应生成一种盐,该盐的化学式为________
Na₂SeO₃
。(2)整个工艺流程中可以循环利用的物质为________
H₂SO₄
(填化学式)。(3)Cu₂Se与浓硫酸反应的化学方程式为________
Cu₂Se+6H₂SO₄(浓$)\xlongequal{焙烧}2CuSO₄+4SO₂↑+SeO₂+6H₂O$
。
答案:
(1)$Na_{2}SeO_{3}$
(2)$H_{2}SO_{4}$
(3)$Cu_{2}Se+6H_{2}SO_{4}(浓)\xlongequal{焙烧}2CuSO_{4}+4SO_{2}\uparrow +SeO_{2}+6H_{2}O$
【解析】
(1)$SeO_{2}$是酸性氧化物,与碱反应生成盐和水,足量 NaOH 溶液吸收烟气中的$SeO_{2}$生成$Na_{2}SeO_{3}$。
(2)根据题图分析,整个工艺流程中可以循环利用的物质为$H_{2}SO_{4}$,即物质 A。
(3)根据题图可知,发生反应的化学方程式为$Cu_{2}Se+6H_{2}SO_{4}(浓)\xlongequal{焙烧}2CuSO_{4}+4SO_{2}\uparrow +SeO_{2}+6H_{2}O$。
(1)$Na_{2}SeO_{3}$
(2)$H_{2}SO_{4}$
(3)$Cu_{2}Se+6H_{2}SO_{4}(浓)\xlongequal{焙烧}2CuSO_{4}+4SO_{2}\uparrow +SeO_{2}+6H_{2}O$
【解析】
(1)$SeO_{2}$是酸性氧化物,与碱反应生成盐和水,足量 NaOH 溶液吸收烟气中的$SeO_{2}$生成$Na_{2}SeO_{3}$。
(2)根据题图分析,整个工艺流程中可以循环利用的物质为$H_{2}SO_{4}$,即物质 A。
(3)根据题图可知,发生反应的化学方程式为$Cu_{2}Se+6H_{2}SO_{4}(浓)\xlongequal{焙烧}2CuSO_{4}+4SO_{2}\uparrow +SeO_{2}+6H_{2}O$。
查看更多完整答案,请扫码查看


