第126页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
【典例】亚氯酸钠(NaClO₂)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO₂饱和溶液在温度低于38℃时析出的晶体是NaClO₂·3H₂O,高于38℃时析出的晶体是NaClO₂,高于60℃时NaClO₂易分解成NaClO₃和NaCl。纯ClO₂易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如图所示:
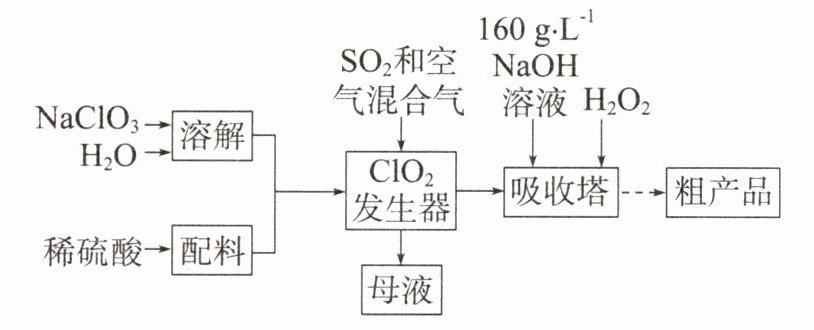
(1)ClO₂发生器中反应的离子方程式为
a.将SO₂氧化成SO₃,增强酸性
b.稀释ClO₂以防止爆炸
c.将NaClO₃还原为ClO₂
(2)吸收塔内反应的化学方程式为
(3)从吸收塔中可获得NaClO₂溶液,从NaClO₂溶液到粗产品(NaClO₂)经过的操作步骤依次为①减压,55℃蒸发结晶;②
解题指导 本工艺流程的目的是制备
(1)ClO₂发生器中,可能参与反应的反应物有
(2)吸收塔可能参与反应的反应物有
(3)从NaClO₂溶液到粗产品(NaClO₂),需要将NaClO₂从溶液中结晶析出。根据题意可知,NaClO₂饱和溶液在温度低于

(1)ClO₂发生器中反应的离子方程式为
2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻
,从“母液”中可回收的主要物质是Na₂SO₄
,发生器中鼓入空气的作用可能是b
(填字母)。a.将SO₂氧化成SO₃,增强酸性
b.稀释ClO₂以防止爆炸
c.将NaClO₃还原为ClO₂
(2)吸收塔内反应的化学方程式为
2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂
,吸收塔的温度不能超过20℃,其原因是防止H₂O₂分解
。(3)从吸收塔中可获得NaClO₂溶液,从NaClO₂溶液到粗产品(NaClO₂)经过的操作步骤依次为①减压,55℃蒸发结晶;②
趁热过滤
;③38~60℃的温水洗涤
;④低于60℃干燥,得到成品。解题指导 本工艺流程的目的是制备
NaClO₂
,含氯原料为NaClO₃
,氯元素的化合价发生变化,因此中间步骤一定涉及氧化还原反应。(1)ClO₂发生器中,可能参与反应的反应物有
NaClO₃、SO₂、H₂O、H₂SO₄
,因产物为ClO₂,氯元素的化合价由+5
变为+4
,因此还原剂为SO₂
,以此得出反应的化学方程式为2NaClO₃ + SO₂ = 2ClO₂ + Na₂SO₄
,离子方程式为2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻
。生成的二氧化氯进入吸收塔中,另一个产物Na₂SO₄
进入“母液”中。根据题意,纯ClO₂易分解爆炸,因此发生器中鼓入空气的作用是稀释ClO₂以防止爆炸。(2)吸收塔可能参与反应的反应物有
ClO₂、NaOH、H₂O₂、H₂O
,产物为NaClO₂
,氯元素的化合价由+4
变为+3
,因此还原剂为H₂O₂
,以此得出反应的化学方程式为2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂
。温度控制一般与反应速率、催化剂活性、物质分解或挥发等相关,根据题意,吸收塔的温度不能超过20℃,其原因是防止H₂O₂分解
。(3)从NaClO₂溶液到粗产品(NaClO₂),需要将NaClO₂从溶液中结晶析出。根据题意可知,NaClO₂饱和溶液在温度低于
38
℃时析出的晶体是NaClO₂·3H₂O,高于38
℃时析出的晶体是NaClO₂,但高于60
℃时NaClO₂易分解成NaClO₃和NaCl。因此若要得到NaClO₂晶体,防止析出NaClO₂·3H₂O晶体,应在温度高于
(填“高于”或“低于”)38℃时趁热过滤,并用温度为38
~60
℃的温水进行洗涤,低于60℃干燥,得到成品。
答案:
(1)2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻ Na₂SO₄ b
(2)2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂ 防止H₂O₂分解
(3)趁热过滤 38~60℃的温水洗涤
NaClO₂ NaClO₃
(1)NaClO₃、SO₂、H₂O、H₂SO₄ +5 +4 SO₂ 2NaClO₃ + SO₂ = 2ClO₂ + Na₂SO₄ 2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻ Na₂SO₄
(2)ClO₂、NaOH、H₂O₂、H₂O NaClO₂ +4 +3 H₂O₂ 2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂ 防止H₂O₂分解
(3)38 38 60 高于 38 60
(1)2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻ Na₂SO₄ b
(2)2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂ 防止H₂O₂分解
(3)趁热过滤 38~60℃的温水洗涤
NaClO₂ NaClO₃
(1)NaClO₃、SO₂、H₂O、H₂SO₄ +5 +4 SO₂ 2NaClO₃ + SO₂ = 2ClO₂ + Na₂SO₄ 2ClO₃⁻ + SO₂ = 2ClO₂ + SO₄²⁻ Na₂SO₄
(2)ClO₂、NaOH、H₂O₂、H₂O NaClO₂ +4 +3 H₂O₂ 2NaOH + 2ClO₂ + H₂O₂ = 2NaClO₂ + 2H₂O + O₂ 防止H₂O₂分解
(3)38 38 60 高于 38 60
查看更多完整答案,请扫码查看


