第128页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
4.Fe₃O₄纳米粒子由于其独特的物理化学性质,在多个领域具有广泛的应用前景。一种利用去除氧化膜的废旧铁皮制备Fe₃O₄纳米粒子的工艺流程如图所示(已知Fe₃O₄中的铁元素为+2、+3价,Fe²⁺在溶液中易被氧化):
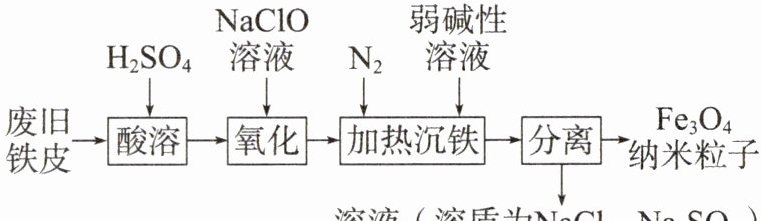
(1)“氧化”时发生反应的离子方程式如下:
2Fe²⁺ + ClO⁻ + 2H⁺ = 2Fe³⁺ +
在方程式上补全缺项,并用单线桥法标出电子转移的方向和数目。
(2)“氧化”时使用的NaClO不宜过多,是因为
(3)“酸溶”时宜用硫酸而不用盐酸,是为了

(1)“氧化”时发生反应的离子方程式如下:
2Fe²⁺ + ClO⁻ + 2H⁺ = 2Fe³⁺ +
Cl⁻
+ H₂O在方程式上补全缺项,并用单线桥法标出电子转移的方向和数目。
(2)“氧化”时使用的NaClO不宜过多,是因为
防止Fe²⁺全部被氧化
。(3)“酸溶”时宜用硫酸而不用盐酸,是为了
防止HCl与NaClO发生反应生成Cl₂污染空气,同时增大NaClO的消耗量
。
答案:
(1)$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$
(2)防止$Fe^{2+}$全部被氧化
(3)防止 HCl 与 NaClO 发生反应生成$Cl_{2}$污染空气,同时增大 NaClO 的消耗量
【解析】废旧铁皮加入$H_{2}SO_{4}$酸溶,生成$FeSO_{4}$等;往溶液中加入 NaClO 溶液,将$Fe^{2+}$部分氧化为$Fe^{3+}$,通入$N_{2}$排除装置内的空气,加入弱碱性溶液进行加热沉铁,此时$Fe^{2+}$、$Fe^{3+}$转化为纳米$Fe_{3}O_{4}$颗粒;过滤分离,得到$Fe_{3}O_{4}$纳米粒子和含有$NaCl$、$Na_{2}SO_{4}$的溶液。
(1)在反应中,$Fe^{2+}$作还原剂,$ClO^{-}$作氧化剂,Cl 元素由 +1 价降低到 -1 价,则生成$Cl^{-}$,依据电荷守恒和质量守恒定律,可得出配平的离子方程式为$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$,在此反应中,电子转移的数目为$2e^{-}$。
(2)因为最终生成$Fe_{3}O_{4}$,$Fe^{2+}$不能完全被氧化,所以“氧化”时使用的 NaClO 不宜过多。
(3)“酸溶”时,若使用盐酸,会与 NaClO 反应生成$Cl_{2}$污染空气,同时增大 NaClO 的消耗量,所以宜用硫酸而不用盐酸。
(1)$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$
(2)防止$Fe^{2+}$全部被氧化
(3)防止 HCl 与 NaClO 发生反应生成$Cl_{2}$污染空气,同时增大 NaClO 的消耗量
【解析】废旧铁皮加入$H_{2}SO_{4}$酸溶,生成$FeSO_{4}$等;往溶液中加入 NaClO 溶液,将$Fe^{2+}$部分氧化为$Fe^{3+}$,通入$N_{2}$排除装置内的空气,加入弱碱性溶液进行加热沉铁,此时$Fe^{2+}$、$Fe^{3+}$转化为纳米$Fe_{3}O_{4}$颗粒;过滤分离,得到$Fe_{3}O_{4}$纳米粒子和含有$NaCl$、$Na_{2}SO_{4}$的溶液。
(1)在反应中,$Fe^{2+}$作还原剂,$ClO^{-}$作氧化剂,Cl 元素由 +1 价降低到 -1 价,则生成$Cl^{-}$,依据电荷守恒和质量守恒定律,可得出配平的离子方程式为$2Fe^{2+}+ClO^{-}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$,在此反应中,电子转移的数目为$2e^{-}$。
(2)因为最终生成$Fe_{3}O_{4}$,$Fe^{2+}$不能完全被氧化,所以“氧化”时使用的 NaClO 不宜过多。
(3)“酸溶”时,若使用盐酸,会与 NaClO 反应生成$Cl_{2}$污染空气,同时增大 NaClO 的消耗量,所以宜用硫酸而不用盐酸。
5.硫酸锰广泛用于医药、电子工业等领域。以软锰矿(主要成分是MnO₂,含少量Fe₂O₃、SiO₂等杂质)为原料生产硫酸锰的工艺流程如图所示。请结合资料回答下列问题:
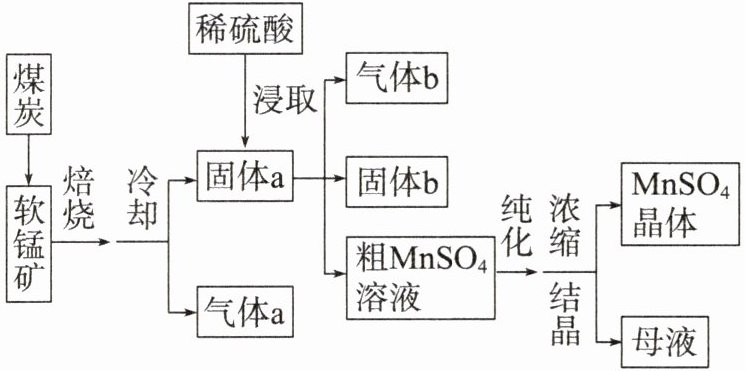
资料1:2MnO₂ + C $\xlongequal{焙烧}$ 2MnO + CO₂↑、2Fe₂O₃ + 3C $\xlongequal{焙烧}$ 4Fe + 3CO₂↑。
资料2:SiO₂不溶于水,也不溶于稀硫酸。
(1)焙烧前将软锰矿和煤炭粉碎的目的是
(2)加入过量的煤炭可保证软锰矿中的MnO₂充分转化为MnO,MnO₂中Mn元素的化合价是
(3)用稀硫酸浸取MnO时发生反应的化学方程式是
(4)固体a中的某物质可与稀硫酸反应生成气体b,该物质是
(5)为了提高原料的利用率,浓缩结晶后剩下的母液应该

资料1:2MnO₂ + C $\xlongequal{焙烧}$ 2MnO + CO₂↑、2Fe₂O₃ + 3C $\xlongequal{焙烧}$ 4Fe + 3CO₂↑。
资料2:SiO₂不溶于水,也不溶于稀硫酸。
(1)焙烧前将软锰矿和煤炭粉碎的目的是
增大反应物接触面积,加快反应速率,提高反应物的转化率
。(2)加入过量的煤炭可保证软锰矿中的MnO₂充分转化为MnO,MnO₂中Mn元素的化合价是
+4
;在该转化过程中,Mn元素的化合价降低
(填“升高”“降低”或“不变”),生成的气体a中除了CO₂外,还可能含有CO
(填化学式)。(3)用稀硫酸浸取MnO时发生反应的化学方程式是
MnO+H₂SO₄=MnSO₄+H₂O
。(4)固体a中的某物质可与稀硫酸反应生成气体b,该物质是
Fe
(填化学式,下同),生成的气体b是H₂
,产生该气体的离子方程式是Fe+2H⁺=Fe²⁺+H₂↑
,该反应类型是置换反应
。(5)为了提高原料的利用率,浓缩结晶后剩下的母液应该
回收利用
(填“回收利用”或“直接排放”)。
答案:
(1)增大反应物接触面积,加快反应速率,提高反应物的转化率
(2)+4 降低 CO
(3)$MnO+H_{2}SO_{4}=MnSO_{4}+H_{2}O$
(4)Fe $H_{2}$ $Fe+2H^{+}=Fe^{2+}+H_{2}\uparrow$ 置换反应
(5)回收利用
【解析】由题图及质量守恒定律可知,向软锰矿中加入煤炭高温焙烧,将二氧化锰转化为一氧化锰,氧化铁转化为铁,煤炭转化为二氧化碳或一氧化碳;向固体 a 中加入稀硫酸浸取,一氧化锰与稀硫酸反应生成硫酸锰和水,铁与稀硫酸反应生成硫酸亚铁和氢气,二氧化硅与稀硫酸不反应;过滤得到含少量硫酸亚铁的粗硫酸锰溶液,纯化后,通过浓缩、结晶、过滤得到硫酸锰晶体和可以回收利用的母液。
(1)增大反应物接触面积,加快反应速率,提高反应物的转化率
(2)+4 降低 CO
(3)$MnO+H_{2}SO_{4}=MnSO_{4}+H_{2}O$
(4)Fe $H_{2}$ $Fe+2H^{+}=Fe^{2+}+H_{2}\uparrow$ 置换反应
(5)回收利用
【解析】由题图及质量守恒定律可知,向软锰矿中加入煤炭高温焙烧,将二氧化锰转化为一氧化锰,氧化铁转化为铁,煤炭转化为二氧化碳或一氧化碳;向固体 a 中加入稀硫酸浸取,一氧化锰与稀硫酸反应生成硫酸锰和水,铁与稀硫酸反应生成硫酸亚铁和氢气,二氧化硅与稀硫酸不反应;过滤得到含少量硫酸亚铁的粗硫酸锰溶液,纯化后,通过浓缩、结晶、过滤得到硫酸锰晶体和可以回收利用的母液。
查看更多完整答案,请扫码查看


