第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
8.(河北中考节选)根据图示的实验回答问题。

该图是金属化学性质的实验。实验前先用砂纸打磨铝丝的目的是______;步骤②中观察到铝丝表面的现象是______。设计该实验的依据是______。

该图是金属化学性质的实验。实验前先用砂纸打磨铝丝的目的是______;步骤②中观察到铝丝表面的现象是______。设计该实验的依据是______。
答案:
去除其表面的$Al_{2}O_{3}$薄膜 有红色固体析出 三种金属的活动性顺序是$Al > Cu > Ag$
9. 某化学兴趣小组的同学,为了比较金属${R}$与铁、铜的金属活动性强弱,进行如下探究活动:
【查阅资料】铁的活动性比铜强,${RSO4}$的溶液为无色。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:${R}>{Fe}>{Cu}$;猜想二:______;猜想三:${Fe}>{Cu}>{R}$。
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
|主要操作|主要现象|实验结论|
|--|--|--|
|甲|将打磨好的${R}$丝插入盛有硫酸铜溶液的试管中|______|猜想一正确|
|乙|将粗细相同并打磨好的${R}$丝、铁丝分别插入体积和浓度都相同的稀盐酸中|${R}$丝表面产生气泡速率比铁丝表面产生气泡速率______(填“快”或“慢”)|
|丙|将粗细相同并打磨好的${R}$丝、铁丝分别在空气中点燃|${R}$丝在空气中剧烈燃烧,铁丝在空气中______|
写出铁丝在氧气中燃烧的化学方程式:______;写出铁丝在稀盐酸中反应的化学方程式:______。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与金属化合物溶液是否反应;
(2)金属与稀盐酸或稀硫酸是否反应或反应的剧烈程度;
(3)金属与______反应的难易程度。
【查阅资料】铁的活动性比铜强,${RSO4}$的溶液为无色。
【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:${R}>{Fe}>{Cu}$;猜想二:______;猜想三:${Fe}>{Cu}>{R}$。
【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
|主要操作|主要现象|实验结论|
|--|--|--|
|甲|将打磨好的${R}$丝插入盛有硫酸铜溶液的试管中|______|猜想一正确|
|乙|将粗细相同并打磨好的${R}$丝、铁丝分别插入体积和浓度都相同的稀盐酸中|${R}$丝表面产生气泡速率比铁丝表面产生气泡速率______(填“快”或“慢”)|
|丙|将粗细相同并打磨好的${R}$丝、铁丝分别在空气中点燃|${R}$丝在空气中剧烈燃烧,铁丝在空气中______|
写出铁丝在氧气中燃烧的化学方程式:______;写出铁丝在稀盐酸中反应的化学方程式:______。
【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与金属化合物溶液是否反应;
(2)金属与稀盐酸或稀硫酸是否反应或反应的剧烈程度;
(3)金属与______反应的难易程度。
答案:
[进行猜想]$Fe > R > Cu$ [收集证据]溶液由蓝色变为无色,R丝表面有红色固体析出 快 不燃烧 $3Fe + 2O_{2}\stackrel{点燃}{=\!=\!=}Fe_{3}O_{4}$ $Fe + 2HCl = FeCl_{2} + H_{2}\uparrow$ [归纳总结]氧气(或$O_{2}$)
10.(核心素养·科学态度与责任)某化学兴趣小组的同学发现一工厂废液中含有${Al2(SO4)3}$、${CuSO4}$,为从废液中回收金属铜,设计流程如下:
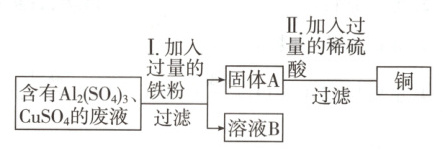
(1)过滤操作中用到的所有玻璃仪器为______。
(2)I中有关反应的化学方程式为______。
(3)溶液B中所含的成分(除水外的物质)是______;固体A的成分是______。(均填化学式)
(4)II中加入过量稀硫酸的目的是______。

(1)过滤操作中用到的所有玻璃仪器为______。
(2)I中有关反应的化学方程式为______。
(3)溶液B中所含的成分(除水外的物质)是______;固体A的成分是______。(均填化学式)
(4)II中加入过量稀硫酸的目的是______。
答案:
(1)漏斗、玻璃棒、烧杯
(2)$Fe + CuSO_{4} = FeSO_{4} + Cu$
(3)$Al_{2}(SO_{4})_{3}$、$FeSO_{4}$ $Cu$、$Fe$
(4)除去过量铁粉
(1)漏斗、玻璃棒、烧杯
(2)$Fe + CuSO_{4} = FeSO_{4} + Cu$
(3)$Al_{2}(SO_{4})_{3}$、$FeSO_{4}$ $Cu$、$Fe$
(4)除去过量铁粉
查看更多完整答案,请扫码查看


