5. (2023·泰州改编)下列有关盐酸性质的学习中,实验方案设计不合理的是(
A.验证浓盐酸的挥发性:打开瓶塞,观察瓶口是否有白雾
B.区分稀盐酸和氯化钠溶液:滴加酚酞试液,观察溶液是否变红色
C.探究盐酸和氢氧化钠溶液反应后溶液的组成:取样,用 pH 试纸检测
D.验证盐酸中 Cl⁻的存在:取样,滴加硝酸酸化的$ AgNO_3$溶液,观察是否有白色沉淀
B
)A.验证浓盐酸的挥发性:打开瓶塞,观察瓶口是否有白雾
B.区分稀盐酸和氯化钠溶液:滴加酚酞试液,观察溶液是否变红色
C.探究盐酸和氢氧化钠溶液反应后溶液的组成:取样,用 pH 试纸检测
D.验证盐酸中 Cl⁻的存在:取样,滴加硝酸酸化的$ AgNO_3$溶液,观察是否有白色沉淀
答案:
B
6. (2023·青岛)实验室有两瓶失去标签的无色溶液,分别是稀盐酸和稀硫酸。下列物质能区分两瓶溶液的是(
A.紫色石蕊试液
B.生锈的铁钉
C.氢氧化钠溶液
D.氯化钡溶液
D
)A.紫色石蕊试液
B.生锈的铁钉
C.氢氧化钠溶液
D.氯化钡溶液
答案:
D
7. 向盛有稀盐酸的烧杯中逐滴加入氢氧化钠溶液,测得烧杯中溶液的 pH 变化如图所示。下列说法正确的是(
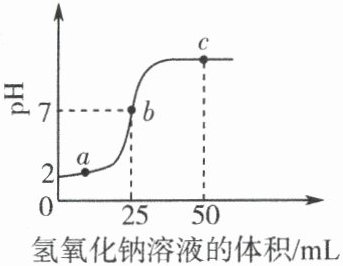
A.a 点所示的溶液中含有的溶质是 NaOH 和 NaCl
B.b 点所示的溶液能使紫色石蕊试液变红
C.c 点表示 NaOH 和稀盐酸恰好完全反应
D.a、b、c 三点所示的溶液中都含有 Na⁺、Cl⁻
D
)
A.a 点所示的溶液中含有的溶质是 NaOH 和 NaCl
B.b 点所示的溶液能使紫色石蕊试液变红
C.c 点表示 NaOH 和稀盐酸恰好完全反应
D.a、b、c 三点所示的溶液中都含有 Na⁺、Cl⁻
答案:
D 解析:a点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故A错误;b点溶液的pH等于7,显中性,不能使紫色石蕊试液变红,故B错误;c点溶液的pH大于7,显碱性,证明氢氧化钠溶液过量,故C错误;氢氧化钠与稀盐酸反应生成氯化钠和水,a、b、c所示的溶液中均含有氯化钠,都含有Na⁺、Cl⁻,故D正确。
8. 探究小组用压强传感器研究蒸馏水或氢氧化钠溶液吸收$ CO_2$的效果。注射器内各装有等体积的液体,同时等速度注入各自锥形瓶中,一段时间后,同时振荡锥形瓶。下列说法不正确的是(

A.曲线 1 表示注入蒸馏水后装置内的压强变化
B.0~t_1$段压强变化的主要原因是注入液体后气体被压缩$
$C.t_1~t_2$段压强变化的主要原因是振荡锥形瓶,使反应进行得更充分
D.对比曲线 1 和曲线 2,可说明 NaOH 溶液吸收$ CO_2$的效果比蒸馏水吸收$ CO_2$的效果好
C
)
A.曲线 1 表示注入蒸馏水后装置内的压强变化
B.0~t_1$段压强变化的主要原因是注入液体后气体被压缩$
$C.t_1~t_2$段压强变化的主要原因是振荡锥形瓶,使反应进行得更充分
D.对比曲线 1 和曲线 2,可说明 NaOH 溶液吸收$ CO_2$的效果比蒸馏水吸收$ CO_2$的效果好
答案:
C
查看更多完整答案,请扫码查看


