14.(9 分)氯化钠是生产、生活中必不可少的物质,用途广泛。
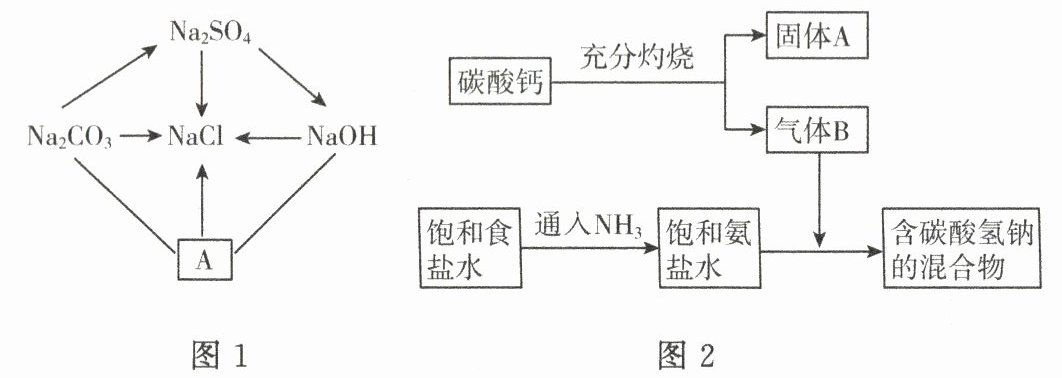
(1)如图 1 所示是有关氯化钠的转化关系,图中“→”表示在一定条件下能实现物质的转化,“—”表示两物质在一定条件下可以发生化学反应。
①已知 A 是人体胃液中含有的酸,其化学式为
②写出图 1 中物质间能相互反应且有气体产生的化学方程式:
③图 1 的物质间转化关系中有的可以逆向转化,它们是
(2)氯化钠是侯氏制碱法的重要原料,如图 2 所示是该工业流程图,请按要求回答下列问题。
①开创了“侯氏制碱法”的化学家是
②写出碳酸钙充分灼烧的化学方程式:
③通入氨气后,饱和氨盐水的 pH
④侯氏制碱法先通入氨气后通入二氧化碳的原因是

(1)如图 1 所示是有关氯化钠的转化关系,图中“→”表示在一定条件下能实现物质的转化,“—”表示两物质在一定条件下可以发生化学反应。
①已知 A 是人体胃液中含有的酸,其化学式为
HCl
。②写出图 1 中物质间能相互反应且有气体产生的化学方程式:
Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑
,该反应属于基本反应类型中的复分解反应
。③图 1 的物质间转化关系中有的可以逆向转化,它们是
NaOH
→Na₂SO₄
。(2)氯化钠是侯氏制碱法的重要原料,如图 2 所示是该工业流程图,请按要求回答下列问题。
①开创了“侯氏制碱法”的化学家是
侯德榜
。②写出碳酸钙充分灼烧的化学方程式:
CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑
。③通入氨气后,饱和氨盐水的 pH
>
7。④侯氏制碱法先通入氨气后通入二氧化碳的原因是
氨气易溶于水,且能使溶液显碱性,能增加二氧化碳的吸收量,有利于析出NaHCO₃晶体
。
答案:
(1)①HCl ②Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑ 复分解反应
③NaOH Na₂SO₄
(2)①侯德榜 ②CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑
③> ④氨气易溶于水,且能使溶液显碱性,能增加二氧化碳的吸收量,有利于析出NaHCO₃晶体
(1)①HCl ②Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑ 复分解反应
③NaOH Na₂SO₄
(2)①侯德榜 ②CaCO₃$\frac{\underline{高温}}{}$CaO+CO₂↑
③> ④氨气易溶于水,且能使溶液显碱性,能增加二氧化碳的吸收量,有利于析出NaHCO₃晶体
15.(6 分)学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质——稀盐酸、碳酸钙粉末、硫酸钠溶液、氯化钡溶液之间的反应进行如图所示的实验探究。
(1)大家一致认为试管①中不发生复分解反应,理由是
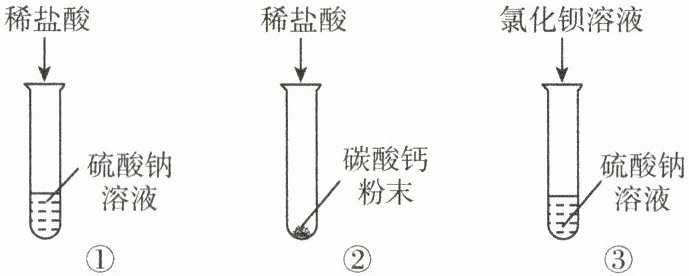
(2)试管②中观察到的现象是
(3)将试管③中反应后的物质过滤,对滤液中溶质的成分进一步探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaCl;猜想二:NaCl、$Na_2SO_4;$猜想三:
【设计实验】

【反思拓展】
Ⅰ. 探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ. 依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用
a. 稀盐酸 b. 氢氧化钠溶液 c. 碳酸钠溶液
(1)大家一致认为试管①中不发生复分解反应,理由是
氯化氢与硫酸钠溶于水解离出的离子不能相互结合生成气体、沉淀或水
。
(2)试管②中观察到的现象是
白色粉末溶解,有气泡产生
。试管③中发生反应的化学方程式为 BaCl₂+Na₂SO₄=BaSO₄↓+2NaCl
。(3)将试管③中反应后的物质过滤,对滤液中溶质的成分进一步探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:NaCl;猜想二:NaCl、$Na_2SO_4;$猜想三:
NaCl、BaCl₂
。【设计实验】

【反思拓展】
Ⅰ. 探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ. 依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用
c
(填字母序号)也能达到同样的实验目的。a. 稀盐酸 b. 氢氧化钠溶液 c. 碳酸钠溶液
答案:
(1)氯化氢与硫酸钠溶于水解离出的离子不能相互结合生成气体、沉淀或水
(2)白色粉末溶解,有气泡产生 BaCl₂+Na₂SO₄=BaSO₄↓+2NaCl
(3)【猜想假设】NaCl、BaCl₂
【设计实验】二 【反思拓展】c
解析:【猜想假设】若试管③中氯化钡与硫酸钠恰好完全反应,则滤液中溶质为NaCl;若硫酸钠过量,则滤液中溶质为NaCl、Na₂SO₄;若氯化钡过量,则滤液中溶质为NaCl、BaCl₂。
【设计实验】取少量滤液于试管中,加入适量BaCl₂溶液,无明显现象,说明溶质不含硫酸钠,猜想二不成立。【反思拓展】稀盐酸与氯化钡不反应,故a不符合题意;氢氧化钠溶液与氯化钡不反应,故b不符合题意;碳酸钠溶液与氯化钡反应生成碳酸钡白色沉淀,故c符合题意。
(1)氯化氢与硫酸钠溶于水解离出的离子不能相互结合生成气体、沉淀或水
(2)白色粉末溶解,有气泡产生 BaCl₂+Na₂SO₄=BaSO₄↓+2NaCl
(3)【猜想假设】NaCl、BaCl₂
【设计实验】二 【反思拓展】c
解析:【猜想假设】若试管③中氯化钡与硫酸钠恰好完全反应,则滤液中溶质为NaCl;若硫酸钠过量,则滤液中溶质为NaCl、Na₂SO₄;若氯化钡过量,则滤液中溶质为NaCl、BaCl₂。
【设计实验】取少量滤液于试管中,加入适量BaCl₂溶液,无明显现象,说明溶质不含硫酸钠,猜想二不成立。【反思拓展】稀盐酸与氯化钡不反应,故a不符合题意;氢氧化钠溶液与氯化钡不反应,故b不符合题意;碳酸钠溶液与氯化钡反应生成碳酸钡白色沉淀,故c符合题意。
查看更多完整答案,请扫码查看


