15. (2023·菏泽)某化学兴趣小组利用数字化实验装置(如图 1 所示)对中和反应进行探究,在烧杯中加入 $ 100 g $ 未知浓度的稀硫酸,向其中滴加 $ 4 \% $ 的氢氧化钠溶液,实验数据经处理后绘制出图像(图 2)。请分析图像回答下列问题。
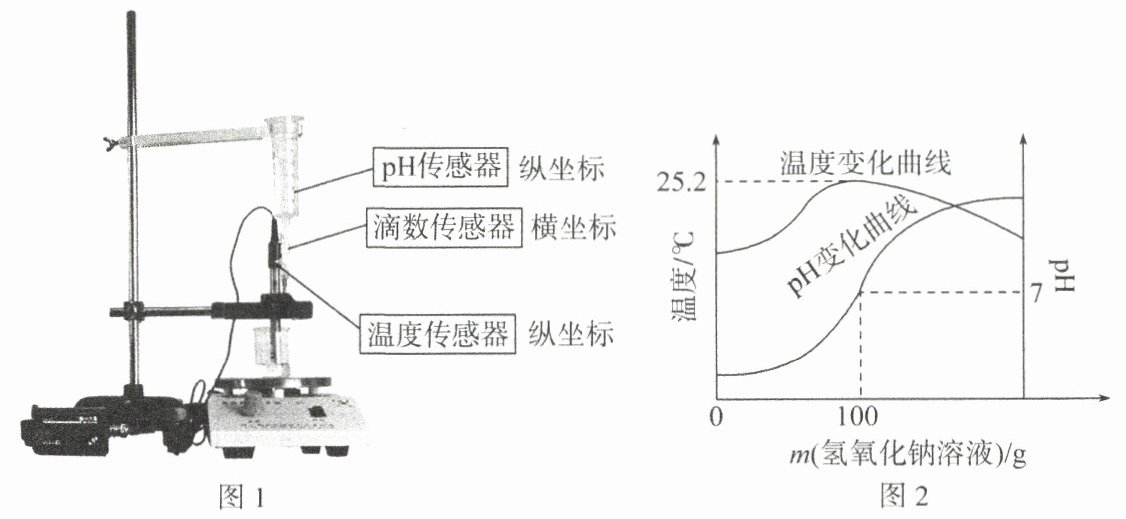
(1)稀硫酸和氢氧化钠溶液发生的反应是 (
(2)计算稀硫酸的溶质质量分数(写出计算过程)。

(1)稀硫酸和氢氧化钠溶液发生的反应是 (
放热
)反应。(2)计算稀硫酸的溶质质量分数(写出计算过程)。
(2)解:恰好反应时,消耗氢氧化钠的质量为$100\ {g}×4\%=4\ {g}$。设稀硫酸中溶质质量分数为$x$。 ${2NaOH +H_{2}SO_{4}\xlongequal{}Na_{2}SO_{4} +2H_{2}O}$
80 98
$4\ {g}$ $100\ {g}× x$
$\dfrac{80}{98}=\dfrac{4\ {g}}{100\ {g}× x}$
$x=4.9\%$
答:稀硫酸的溶质质量分数为$4.9\%$。
80 98
$4\ {g}$ $100\ {g}× x$
$\dfrac{80}{98}=\dfrac{4\ {g}}{100\ {g}× x}$
$x=4.9\%$
答:稀硫酸的溶质质量分数为$4.9\%$。
答案:
(1)放热
(2)解:恰好反应时,消耗氢氧化钠的质量为$100\ {g}×4\%=4\ {g}$。设稀硫酸中溶质质量分数为$x$。 ${2NaOH +H_{2}SO_{4}\xlongequal{}Na_{2}SO_{4} +2H_{2}O}$
80 98
$4\ {g}$ $100\ {g}× x$
$\dfrac{80}{98}=\dfrac{4\ {g}}{100\ {g}× x}$
$x=4.9\%$
答:稀硫酸的溶质质量分数为$4.9\%$。
(1)放热
(2)解:恰好反应时,消耗氢氧化钠的质量为$100\ {g}×4\%=4\ {g}$。设稀硫酸中溶质质量分数为$x$。 ${2NaOH +H_{2}SO_{4}\xlongequal{}Na_{2}SO_{4} +2H_{2}O}$
80 98
$4\ {g}$ $100\ {g}× x$
$\dfrac{80}{98}=\dfrac{4\ {g}}{100\ {g}× x}$
$x=4.9\%$
答:稀硫酸的溶质质量分数为$4.9\%$。
查看更多完整答案,请扫码查看


