第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
1.(2023广州,14)关于下列实验的说法,正确的是 ( )
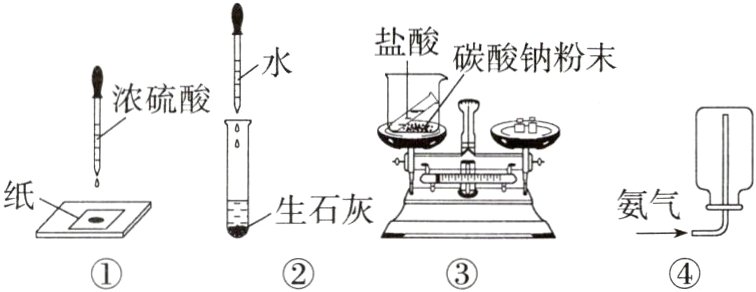
A.实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性
B.实验②:试管壁发烫,说明物质溶解过程伴随热量变化
C.实验③:反应后总质量减小,说明该反应不符合质量守恒定律
D.实验④:氨气用向下排空气法收集,说明氨气的密度比空气大

A.实验①:滴有浓硫酸的部位变黑,说明浓硫酸有腐蚀性
B.实验②:试管壁发烫,说明物质溶解过程伴随热量变化
C.实验③:反应后总质量减小,说明该反应不符合质量守恒定律
D.实验④:氨气用向下排空气法收集,说明氨气的密度比空气大
答案:
A 浓硫酸具有腐蚀性,能夺取物质中的氢元素和氧元素,按水的组成比脱去,生成黑色的炭,故浓硫酸能腐蚀纸,使纸变黑,故A正确;生石灰与水反应生成熟石灰,该过程产生大量热,属于化学变化,故B错误;盐酸与碳酸钠粉末在敞口容器中反应,造成产生的二氧化碳气体逸出,使反应后烧杯中剩余物质的质量减小,并非不符合质量守恒定律,故C错误;用向下排空气法收集氨气,说明氨气密度比空气小,故D错误。
2.(2023广州,13)钴(Co)的金属活动性与铁相似,钴的化合物相关性质如下。下列预测合理的是 ( )
|物质|CoO|Co(OH)₂|CoCl₂|CoCO₃|
|--|--|--|--|--|
|在水中的溶解性|难溶,灰绿色固体|难溶,粉红色固体|易溶,溶液呈粉红色|难溶,粉红色固体|
A.Co能从MgCl₂溶液中置换出Mg
B.CoO能与盐酸反应得到粉红色溶液
C.CoCO₃能与盐酸反应生成H₂
D.Co(OH)₂可由Co与NaOH溶液反应制得
|物质|CoO|Co(OH)₂|CoCl₂|CoCO₃|
|--|--|--|--|--|
|在水中的溶解性|难溶,灰绿色固体|难溶,粉红色固体|易溶,溶液呈粉红色|难溶,粉红色固体|
A.Co能从MgCl₂溶液中置换出Mg
B.CoO能与盐酸反应得到粉红色溶液
C.CoCO₃能与盐酸反应生成H₂
D.Co(OH)₂可由Co与NaOH溶液反应制得
答案:
B 钴的金属活动性与铁相似,铁的金属活动性比镁弱,故钴单质不能将镁从氯化镁溶液中置换出来,故A 不合理;CoO为金属氧化物,能与盐酸反应生成CoCl₂和水,CoCl₂易溶,溶液呈粉红色,故B合理;CoCO₃能与盐酸反应生成CO₂,化学方程式为CoCO₃+2HCl=CoCl₂+H₂O+CO₂↑,故C不合理;Fe不能与NaOH溶液反应,推测Co也不能,故D不合理。
3.(2020深圳,10)如图,将胶头滴管中的物质X滴入装有物质Y的试管中,两物质充分反应。下列说法错误的是 ( )

A.X为稀硫酸,若反应有气泡产生,则生成的气体一定是H₂
B.X为AgNO₃溶液,Y为Cu片,根据现象可判断金属活动性:Cu>Ag
C.X为BaCl₂溶液,Y为Na₂SO₄溶液,反应产生白色沉淀
D.X为稀盐酸,Y为Al(OH)₃,该反应可应用于治疗胃酸过多症

A.X为稀硫酸,若反应有气泡产生,则生成的气体一定是H₂
B.X为AgNO₃溶液,Y为Cu片,根据现象可判断金属活动性:Cu>Ag
C.X为BaCl₂溶液,Y为Na₂SO₄溶液,反应产生白色沉淀
D.X为稀盐酸,Y为Al(OH)₃,该反应可应用于治疗胃酸过多症
答案:
A A项,稀硫酸与活泼金属反应产生氢气,与碳酸盐反应可产生二氧化碳气体,错误。
4.(2021广州,16)某校学生利用以下两个实验探究酸的性质。

(1)试管A中溶液变浑浊的反应是______________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na₂CO₃,除去钙、铁元素和过量的酸,可观察到:①______________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加______________________溶液,无明显现象,钙元素已除尽。
(4)若处理废液时共消耗Na₂CO₃ 212 g,则实验室为本次探究实验至少准备了______g盐酸。(已知盐酸的质量分数为7.3%)

(1)试管A中溶液变浑浊的反应是______________________(写化学方程式)。
(2)试管B中铁钉变得光亮且表面有气泡生成,溶液呈黄色,将此时溶液中和液面上方存在的微观粒子的种类在图中补充完整(粒子数目不作要求;不考虑空气、水)。
(3)将所有学生完成上述两个实验产生的废液收集并处理,向该废液中加入适量Na₂CO₃,除去钙、铁元素和过量的酸,可观察到:①______________________,②产生大量沉淀。静置过滤得到无色溶液,经检测pH约为7,取样滴加______________________溶液,无明显现象,钙元素已除尽。
(4)若处理废液时共消耗Na₂CO₃ 212 g,则实验室为本次探究实验至少准备了______g盐酸。(已知盐酸的质量分数为7.3%)
答案:
答案
(1)CO₂+Ca(OH)₂=CaCO₃↓+H₂O
(2)

(3)产生气泡 Na₂CO₃
(4)2000
解析
(2)试管B中发生反应为Fe₂O₃+6HCl=2FeCl₃+3H₂O、Fe+2HCl=FeCl₂+H₂↑,故溶液中存在的离子除H⁺和Cl⁻外,还有Fe³⁺和Fe²⁺,液面上方有H₂和挥发出的HCl。
(3)Na₂CO₃能与溶液中的Ca²⁺、Fe²⁺和Fe³⁺反应生成沉淀,能与溶液中的H⁺反应生成CO₂;往过滤得到的无色滤液中滴加Na₂CO₃溶液,若无沉淀生成,则溶液中不存在Ca²⁺。
(4)设实验室为本次探究实验准备的盐酸的质量至少为x,分析实验过程可知,Na₂CO₃转化成了NaCl,其中的氯元素完全来自盐酸,据此可得
Na₂CO₃~2NaCl~2HCl
106 73
212g 7.3%×x
$\frac{106}{73}$=$\frac{212g}{7.3\%×x}$,x=2000g。
答案
(1)CO₂+Ca(OH)₂=CaCO₃↓+H₂O
(2)

(3)产生气泡 Na₂CO₃
(4)2000
解析
(2)试管B中发生反应为Fe₂O₃+6HCl=2FeCl₃+3H₂O、Fe+2HCl=FeCl₂+H₂↑,故溶液中存在的离子除H⁺和Cl⁻外,还有Fe³⁺和Fe²⁺,液面上方有H₂和挥发出的HCl。
(3)Na₂CO₃能与溶液中的Ca²⁺、Fe²⁺和Fe³⁺反应生成沉淀,能与溶液中的H⁺反应生成CO₂;往过滤得到的无色滤液中滴加Na₂CO₃溶液,若无沉淀生成,则溶液中不存在Ca²⁺。
(4)设实验室为本次探究实验准备的盐酸的质量至少为x,分析实验过程可知,Na₂CO₃转化成了NaCl,其中的氯元素完全来自盐酸,据此可得
Na₂CO₃~2NaCl~2HCl
106 73
212g 7.3%×x
$\frac{106}{73}$=$\frac{212g}{7.3\%×x}$,x=2000g。
查看更多完整答案,请扫码查看


