第104页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
10.(2024广州)碳酸锂(Li₂CO₃)广泛应用于电池、陶瓷和医药等领域。利用浓缩后的盐湖卤水(含有NaCl、LiCl、Li₂SO₄和MgCl₂)制备Li₂CO₃的工艺流程如下:

(1)浓缩后的盐湖卤水中含有的金属阳离子除Li⁺外,还有__________(填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO₄外,还有__________。
(3)“除杂2”中加入Na₂CO₃溶液的目的是______________________________。
(4)“滤液2”显______性(填“酸”“中”或“碱”)。
(5)结合下图分析:
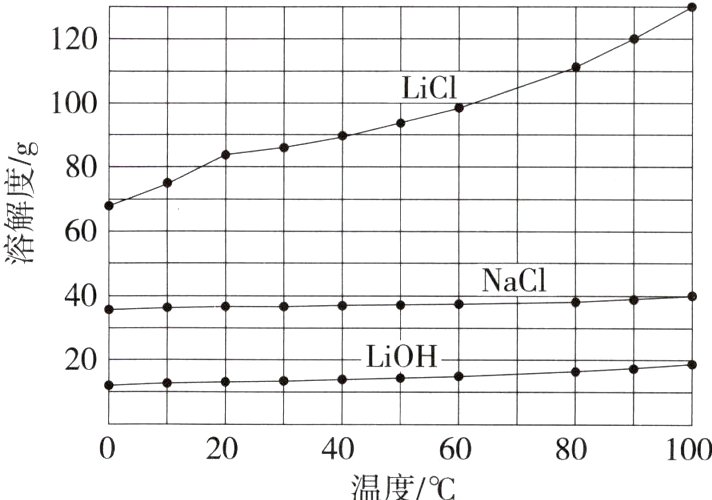
①“调pH”至溶液显中性,“操作1”为__________。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是______________________________。
(6)“滤液3”一定是__________(填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为______________________________。

(1)浓缩后的盐湖卤水中含有的金属阳离子除Li⁺外,还有__________(填离子符号)。
(2)“除杂1”所得滤渣的主要成分除CaSO₄外,还有__________。
(3)“除杂2”中加入Na₂CO₃溶液的目的是______________________________。
(4)“滤液2”显______性(填“酸”“中”或“碱”)。
(5)结合下图分析:

①“调pH”至溶液显中性,“操作1”为__________。
②若未加盐酸“调pH”而直接进行“操作1”,析出的NaCl固体中可能含有LiOH,原因是______________________________。
(6)“滤液3”一定是__________(填化学式)的饱和溶液。
(7)“沉锂”时发生反应的化学方程式为______________________________。
答案:
答案
(1)Na⁺、Mg²⁺
(2)Mg(OH)₂
(3)除去Ca²⁺
(4)碱
(5)①蒸发结晶,过滤 ②滤液2中含LiOH,溶解度曲线中LiOH的溶解度受温度变化影响小且LiOH的溶解度小于NaCl的溶解度
(6)NaCl
(7)Na₂CO₃ + 2LiCl = Li₂CO₃↓ + 2NaCl
解析
(1)浓缩后的盐湖卤水含有NaCl、LiCl、Li₂SO₄和MgCl₂,金属阳离子除Li⁺外,还有Na⁺、Mg²⁺。
(2)Ca(OH)₂中的Ca²⁺能与卤水中的SO₄²⁻结合为CaSO₄沉淀,OH⁻能与卤水中的Mg²⁺结合为Mg(OH)₂沉淀,因此“除杂1”所得滤渣的主要成分除CaSO₄外还有Mg(OH)₂。
(3)“除杂2”中加入Na₂CO₃溶液的目的是除去之前加入Ca(OH)₂时引入的Ca²⁺,避免对后续Li₂CO₃的制备产生干扰。
(4)除杂时加入的试剂一般过量,Na₂CO₃溶液呈碱性,且除杂1过程中产生LiOH,除杂2过程中产生NaOH,故滤液2显碱性。
(5)①“调pH”的目的是除去滤液2中的CO₃²⁻和OH⁻,加入盐酸后,滤液中溶质的主要成分为LiCl和NaCl,题图显示相同温度下NaCl溶解度小于LiCl的,且氯化钠的溶解度受温度影响较小,故将滤液蒸发结晶后过滤,可得到NaCl固体;②题图中LiOH的溶解度受温度变化影响小且相同温度下LiOH的溶解度小于NaCl的溶解度,滤液2中含LiOH,若未加盐酸“调pH”,直接进行“操作1”,析出的NaCl固体中可能含有LiOH。
(6)“滤液3”是析出NaCl固体后所得溶液,故“滤液3”一定是NaCl的饱和溶液。
(7)滤液3中溶质的主要成分为LiCl,则“沉锂”时,饱和Na₂CO₃溶液和LiCl反应生成Li₂CO₃固体和NaCl。
(1)Na⁺、Mg²⁺
(2)Mg(OH)₂
(3)除去Ca²⁺
(4)碱
(5)①蒸发结晶,过滤 ②滤液2中含LiOH,溶解度曲线中LiOH的溶解度受温度变化影响小且LiOH的溶解度小于NaCl的溶解度
(6)NaCl
(7)Na₂CO₃ + 2LiCl = Li₂CO₃↓ + 2NaCl
解析
(1)浓缩后的盐湖卤水含有NaCl、LiCl、Li₂SO₄和MgCl₂,金属阳离子除Li⁺外,还有Na⁺、Mg²⁺。
(2)Ca(OH)₂中的Ca²⁺能与卤水中的SO₄²⁻结合为CaSO₄沉淀,OH⁻能与卤水中的Mg²⁺结合为Mg(OH)₂沉淀,因此“除杂1”所得滤渣的主要成分除CaSO₄外还有Mg(OH)₂。
(3)“除杂2”中加入Na₂CO₃溶液的目的是除去之前加入Ca(OH)₂时引入的Ca²⁺,避免对后续Li₂CO₃的制备产生干扰。
(4)除杂时加入的试剂一般过量,Na₂CO₃溶液呈碱性,且除杂1过程中产生LiOH,除杂2过程中产生NaOH,故滤液2显碱性。
(5)①“调pH”的目的是除去滤液2中的CO₃²⁻和OH⁻,加入盐酸后,滤液中溶质的主要成分为LiCl和NaCl,题图显示相同温度下NaCl溶解度小于LiCl的,且氯化钠的溶解度受温度影响较小,故将滤液蒸发结晶后过滤,可得到NaCl固体;②题图中LiOH的溶解度受温度变化影响小且相同温度下LiOH的溶解度小于NaCl的溶解度,滤液2中含LiOH,若未加盐酸“调pH”,直接进行“操作1”,析出的NaCl固体中可能含有LiOH。
(6)“滤液3”是析出NaCl固体后所得溶液,故“滤液3”一定是NaCl的饱和溶液。
(7)滤液3中溶质的主要成分为LiCl,则“沉锂”时,饱和Na₂CO₃溶液和LiCl反应生成Li₂CO₃固体和NaCl。
查看更多完整答案,请扫码查看


