2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. 某化学小组测定酸性条件下KClO₃溶液与NaHSO₃溶液反应的化学反应速率,所用的试剂为10 mL 0.1 mol·L⁻¹ KClO₃溶液和10 mL 0.3 mol·L⁻¹ NaHSO₃溶液,c(Cl⁻)随时间变化的曲线如图所示。下列说法错误的是 (
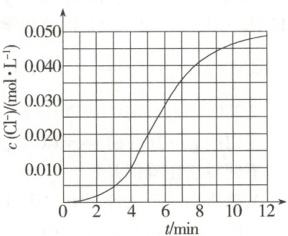
A.该反应的离子方程式为ClO₃⁻+3HSO₃⁻=Cl⁻+3SO₄²⁻+3H⁺
B.该反应在0~4 min内的平均反应速率v(ClO₃⁻)=2.5×10⁻³ mol·L⁻¹·min⁻¹
C.在反应过程中,该反应的化学反应速率先增大后减小
D.起初反应速率很小,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
D
)
A.该反应的离子方程式为ClO₃⁻+3HSO₃⁻=Cl⁻+3SO₄²⁻+3H⁺
B.该反应在0~4 min内的平均反应速率v(ClO₃⁻)=2.5×10⁻³ mol·L⁻¹·min⁻¹
C.在反应过程中,该反应的化学反应速率先增大后减小
D.起初反应速率很小,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
答案:
15.D 根据得失电子守恒、原子守恒和电荷守恒,可得该反应的离子方程式为ClO₃⁻ + 3HSO₃⁻ = Cl⁻ + 3SO₄²⁻ + 3H⁺,A正确;由题图中数据可知,该反应在0 - 4min内的平均反应速率v(Cl⁻)=$\frac{0.010mol·L⁻¹}{4min}$ = 2.5×10⁻³mol·L⁻¹·min⁻¹,v(ClO₃⁻)=v(Cl⁻)=2.5×10⁻³mol·L⁻¹·min⁻¹,B正确;反应速率很小,一段时间后反应速率明显增大,可能是因为反应放热使 体系温度升高,也可能是因为生成的Cl⁻对反应有催化作用等,D错误。
16. (10分)按要求回答以下问题。
(1) 请将符合题意的下列变化的序号填在对应的横线上。
①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
化学键没有被破坏的是
(2) NH₃的电子式为
(3) 汽车尾气中含有NO、CO等有害气体。NO生成过程的能量变化如图1所示。则1 mol N₂和1 mol O₂完全反应生成NO会

(4) 利用反应2NO(g)+2CO(g)⇌N₂(g)+2CO₂(g)可实现汽车尾气的无害化处理。一定温度下,在体积为2 L的恒容密闭容器中通入等物质的量的NO和CO,发生上述反应,测得部分物质的物质的量随时间的变化如图2所示。X代表的物质是

(1) 请将符合题意的下列变化的序号填在对应的横线上。
①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
化学键没有被破坏的是
①②
;仅离子键被破坏的是③④
;既破坏离子键又破坏共价键的是⑥
。(2) NH₃的电子式为
H:$\underset{··}{\overset{··}{N}}$:H
,用电子式表示MgCl₂的形成过程:$\underset{··}{\overset{··}{Cl}}$: + $\underset{··}{\overset{··}{Mg}}$ + :$\underset{··}{\overset{··}{Cl}}$: → [:$\underset{··}{\overset{··}{Cl}}$:]$^-$Mg²⁺[:$\underset{··}{\overset{··}{Cl}}$:]$^-$
。(3) 汽车尾气中含有NO、CO等有害气体。NO生成过程的能量变化如图1所示。则1 mol N₂和1 mol O₂完全反应生成NO会
吸收
(填“吸收”或“放出”)180
kJ能量。
(4) 利用反应2NO(g)+2CO(g)⇌N₂(g)+2CO₂(g)可实现汽车尾气的无害化处理。一定温度下,在体积为2 L的恒容密闭容器中通入等物质的量的NO和CO,发生上述反应,测得部分物质的物质的量随时间的变化如图2所示。X代表的物质是
CO₂
;a点正反应速率>
(填“>”“<”或“=”)逆反应速率。
答案:
16.答案 (除标注外,每空1分)
(1)①②③④ ⑥
(2)H:$\underset{··}{\overset{··}{N}}$:H :$\underset{··}{\overset{··}{Cl}}$: + $\underset{··}{\overset{··}{Mg}}$ + :$\underset{··}{\overset{··}{Cl}}$: → [:$\underset{··}{\overset{··}{Cl}}$:]$^-$Mg²⁺[:$\underset{··}{\overset{··}{Cl}}$:]$^-$(2分)
(3)吸收 180
(4)CO₂ >
解析
(1)①碘的升华属于物理变化,只是状态发生变化,化学键没有 被破坏;②氧气溶于水属于物理变化,化学键没有被破坏;③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏;④烧碱熔化,离子 键被破坏;⑤氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被 破坏;⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子 键、共价键,受热分解时破坏的是离子键、共价键。
(2)氨气是只含有 共价键的共价化合物,氨气的电子式为H:$\underset{··}{\overset{··}{N}}$:H,用电子式表示MgCl₂ 的形成过程为:$\underset{··}{\overset{··}{Cl}}$: + $\underset{··}{\overset{··}{Mg}}$ + :$\underset{··}{\overset{··}{Cl}}$: → [:$\underset{··}{\overset{··}{Cl}}$:]$^-$Mg²⁺[:$\underset{··}{\overset{··}{Cl}}$:]$^-$。
(3)由题图1可知, 1molN₂(g)和1molO₂(g)完全反应生成2molNO(g)时,断裂反应物中 化学键吸收的总能量为946kJ + 498kJ = 1444kJ,形成生成物中化学键 放出的总能量为2×632kJ = 1264kJ,则反应时需要吸收180kJ的能 量。
(4)平衡时生成X1.6mol,消耗NO和CO的物质的量均是 1.6mol,根据化学方程式可知X代表的物质是CO₂;a点反应向正反应 方向进行,则正反应速率大于逆反应速率。
(1)①②③④ ⑥
(2)H:$\underset{··}{\overset{··}{N}}$:H :$\underset{··}{\overset{··}{Cl}}$: + $\underset{··}{\overset{··}{Mg}}$ + :$\underset{··}{\overset{··}{Cl}}$: → [:$\underset{··}{\overset{··}{Cl}}$:]$^-$Mg²⁺[:$\underset{··}{\overset{··}{Cl}}$:]$^-$(2分)
(3)吸收 180
(4)CO₂ >
解析
(1)①碘的升华属于物理变化,只是状态发生变化,化学键没有 被破坏;②氧气溶于水属于物理变化,化学键没有被破坏;③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏;④烧碱熔化,离子 键被破坏;⑤氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被 破坏;⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子 键、共价键,受热分解时破坏的是离子键、共价键。
(2)氨气是只含有 共价键的共价化合物,氨气的电子式为H:$\underset{··}{\overset{··}{N}}$:H,用电子式表示MgCl₂ 的形成过程为:$\underset{··}{\overset{··}{Cl}}$: + $\underset{··}{\overset{··}{Mg}}$ + :$\underset{··}{\overset{··}{Cl}}$: → [:$\underset{··}{\overset{··}{Cl}}$:]$^-$Mg²⁺[:$\underset{··}{\overset{··}{Cl}}$:]$^-$。
(3)由题图1可知, 1molN₂(g)和1molO₂(g)完全反应生成2molNO(g)时,断裂反应物中 化学键吸收的总能量为946kJ + 498kJ = 1444kJ,形成生成物中化学键 放出的总能量为2×632kJ = 1264kJ,则反应时需要吸收180kJ的能 量。
(4)平衡时生成X1.6mol,消耗NO和CO的物质的量均是 1.6mol,根据化学方程式可知X代表的物质是CO₂;a点反应向正反应 方向进行,则正反应速率大于逆反应速率。
查看更多完整答案,请扫码查看


