2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (10分)为比较Fe³⁺和Cu²⁺对H₂O₂分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1) 定性分析:如图甲所示,可通过观察
(2) 定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均保持相同。实验中需要测量的数据是
(3) 查阅资料得知:将Fe₂(SO₄)₃溶液加入H₂O₂溶液中后,溶液中会发生两个氧化还原反应,且两个反应中H₂O₂均参加了反应。试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe³⁺+H₂O₂=2Fe²⁺+O₂↑+2H⁺和

(1) 定性分析:如图甲所示,可通过观察
产生气泡
的快慢,定性比较得出结论。有同学提出将0.1 mol·L⁻¹ FeCl₃溶液改为0.05
mol·L⁻¹ Fe₂(SO₄)₃溶液更为合理,其理由是排除阴离子不同对实验的干扰
。(2) 定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均保持相同。实验中需要测量的数据是
产生40mL气体所需的时间
。(3) 查阅资料得知:将Fe₂(SO₄)₃溶液加入H₂O₂溶液中后,溶液中会发生两个氧化还原反应,且两个反应中H₂O₂均参加了反应。试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是2Fe³⁺+H₂O₂=2Fe²⁺+O₂↑+2H⁺和
2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O
。
答案:
17.答案 (每空2分)
(1)产生气泡 0.05 排除阴离子不同对实验的干扰
(2)产生40mL气体所需的时间
(3)2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O
解析
(1)该反应中产生气体,可根据生成气泡的快慢得出结论。氯 化铁和硫酸铜中阴、阳离子都不同,硫酸铁和硫酸铜的阴离子相同,可以 排除阴离子不同对实验的干扰,且应该保持Fe³⁺浓度仍为0.1mol·L⁻¹,故 改为0.05mol·L⁻¹Fe₂(SO₄)₃溶液更合理。
(3)已知①2H₂O₂ = 2H₂O + O₂↑,②2Fe³⁺ + H₂O₂ = 2Fe²⁺ + O₂↑ + 2H⁺,由① - ②得另一反应为2H⁺ + 2Fe²⁺ + H₂O₂ = 2Fe³⁺ + 2H₂O。
(1)产生气泡 0.05 排除阴离子不同对实验的干扰
(2)产生40mL气体所需的时间
(3)2Fe²⁺ + H₂O₂ + 2H⁺ = 2Fe³⁺ + 2H₂O
解析
(1)该反应中产生气体,可根据生成气泡的快慢得出结论。氯 化铁和硫酸铜中阴、阳离子都不同,硫酸铁和硫酸铜的阴离子相同,可以 排除阴离子不同对实验的干扰,且应该保持Fe³⁺浓度仍为0.1mol·L⁻¹,故 改为0.05mol·L⁻¹Fe₂(SO₄)₃溶液更合理。
(3)已知①2H₂O₂ = 2H₂O + O₂↑,②2Fe³⁺ + H₂O₂ = 2Fe²⁺ + O₂↑ + 2H⁺,由① - ②得另一反应为2H⁺ + 2Fe²⁺ + H₂O₂ = 2Fe³⁺ + 2H₂O。
18. (10分)为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1) 将纯净的固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带玻璃弯管的塞子,发现管内红墨水的液面高度如图1、图2所示。
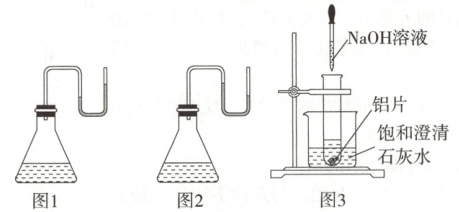
① 若如图1所示,发生的反应(假设没有气体生成)是
② 若如图2所示,发生的反应(假设没有气体生成)是
A. CO还原CuO的反应
B. CaCO₃的分解反应
C. Al和Fe₂O₃的反应
(2) 如图3所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中放入少量铝片,再滴入5 mL NaOH溶液。
① 实验中观察到的现象是铝片逐渐溶解、有大量气泡产生、
② 产生上述现象的原因是
(1) 将纯净的固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带玻璃弯管的塞子,发现管内红墨水的液面高度如图1、图2所示。

① 若如图1所示,发生的反应(假设没有气体生成)是
放热
(填“放热”或“吸热”)反应,X可以是CaO
(填化学式,填一种即可)。② 若如图2所示,发生的反应(假设没有气体生成)是
吸热
(填“放热”或“吸热”)反应。以下选项中与其能量变化相同的是B
(填字母)。A. CO还原CuO的反应
B. CaCO₃的分解反应
C. Al和Fe₂O₃的反应
(2) 如图3所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中放入少量铝片,再滴入5 mL NaOH溶液。
① 实验中观察到的现象是铝片逐渐溶解、有大量气泡产生、
饱和澄清石灰水变浑浊
。② 产生上述现象的原因是
铝和NaOH溶液反应生成H₂,且该反应是放热反应,Ca(OH)₂的溶解度随温度的升高而降低
。
答案:
18.答案 (除标注外,每空2分)
(1)①放热(1分) CaO(答案合理即可) ②吸热(1分) B
(2)①饱和澄清石灰水变浑浊 ②铝和NaOH溶液反应生成H₂,且该反应是放热反应,Ca(OH)₂的溶解度随温度的升高而降低
解析
(1)①若如图1所示,体系内压强大于外界大气压,说明体系内气体膨胀,反应放热,故物质X可以是Na₂O、CaO等。
②若如图2所示,体系内压强小于外界大气压,说明体系内气体体积缩小,反应吸热。CO还原CuO的反应为放热反应,CaCO₃的分解反应为吸热反应,Al和Fe₂O₃的反应为放热反应。
(2)把试管放入盛有25℃饱和澄清石灰水的烧杯中,向试管中放入少量铝片,再滴入5mLNaOH溶液,铝和NaOH溶液反应生成H₂,且该反应是放热反应,Ca(OH)₂的溶解度随温度的升高而降低,烧杯中饱和澄清石灰水变浑浊。
(1)①放热(1分) CaO(答案合理即可) ②吸热(1分) B
(2)①饱和澄清石灰水变浑浊 ②铝和NaOH溶液反应生成H₂,且该反应是放热反应,Ca(OH)₂的溶解度随温度的升高而降低
解析
(1)①若如图1所示,体系内压强大于外界大气压,说明体系内气体膨胀,反应放热,故物质X可以是Na₂O、CaO等。
②若如图2所示,体系内压强小于外界大气压,说明体系内气体体积缩小,反应吸热。CO还原CuO的反应为放热反应,CaCO₃的分解反应为吸热反应,Al和Fe₂O₃的反应为放热反应。
(2)把试管放入盛有25℃饱和澄清石灰水的烧杯中,向试管中放入少量铝片,再滴入5mLNaOH溶液,铝和NaOH溶液反应生成H₂,且该反应是放热反应,Ca(OH)₂的溶解度随温度的升高而降低,烧杯中饱和澄清石灰水变浑浊。
查看更多完整答案,请扫码查看


