2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
11. 一定温度下,向2 L密闭容器中充入0.4 mol NH₃和0.5 mol O₂发生反应:4NH₃(g)+5O₂(g)⇌4NO(g)+6H₂O(g)。2 min末,NO的物质的量为0.2 mol。下列有关说法不正确的是 (
A.2 min末,NH₃的浓度为0.1 mol·L⁻¹
B.0~2 min内,用NH₃表示的平均反应速率为0.05 mol·L⁻¹·min⁻¹
C.2 min末,生成的H₂O的物质的量为0.3 mol
D.反应达平衡时,NO的浓度为0.2 mol·L⁻¹
D
)A.2 min末,NH₃的浓度为0.1 mol·L⁻¹
B.0~2 min内,用NH₃表示的平均反应速率为0.05 mol·L⁻¹·min⁻¹
C.2 min末,生成的H₂O的物质的量为0.3 mol
D.反应达平衡时,NO的浓度为0.2 mol·L⁻¹
答案:
11.D 2min末,NO的物质的量为0.2mol,则消耗NH₃0.2mol,2min末,NH₃的物质的量为0.4mol - 0.2mol = 0.2mol,容器容积为2L,则NH₃ 的浓度为0.1mol·L⁻¹,A正确;0 - 2min内,用NH₃表示的平均反应速率为$\frac{0.1mol·L⁻¹}{2min}$ = 0.05mol·L⁻¹·min⁻¹,B正确;生成0.2molNO的同时生成0.3molH₂O,C正确;若0.4molNH₃完全反应,则生成NO 0.4mol,浓度为0.2mol·L⁻¹,但该反应是可逆反应,不能进行到底,所以反应达平衡时,NO的浓度小于0.2mol·L⁻¹,D错误。
12. H₂、CO、CH₄完全燃烧的热化学方程式可以分别表示为:
① H₂(g)+½O₂(g)=H₂O(l) ΔH=-285.8 kJ·mol⁻¹
② 2CO(g)+O₂(g)=2CO₂(g) ΔH=-565.2 kJ·mol⁻¹
③ CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH=-890.3 kJ·mol⁻¹
下列说法正确的是 (
A.热值指一定条件下单位质量的可燃物完全燃烧所放出的热量,H₂、CO、CH₄中热值最大的是CH₄
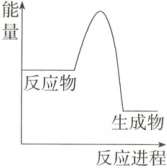
B.反应①的反应过程可用右图表示
C.由反应②可推出:CO₂(g)=CO(g)+½O₂(g)的ΔH=-282.6 kJ·mol⁻¹
D.反应③表示1 mol CH₄(g)和足量O₂(g)完全反应生成二氧化碳和气态水放热890.3 kJ
① H₂(g)+½O₂(g)=H₂O(l) ΔH=-285.8 kJ·mol⁻¹
② 2CO(g)+O₂(g)=2CO₂(g) ΔH=-565.2 kJ·mol⁻¹
③ CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH=-890.3 kJ·mol⁻¹
下列说法正确的是 (
B
)A.热值指一定条件下单位质量的可燃物完全燃烧所放出的热量,H₂、CO、CH₄中热值最大的是CH₄
B.反应①的反应过程可用右图表示

C.由反应②可推出:CO₂(g)=CO(g)+½O₂(g)的ΔH=-282.6 kJ·mol⁻¹
D.反应③表示1 mol CH₄(g)和足量O₂(g)完全反应生成二氧化碳和气态水放热890.3 kJ
答案:
12.B 根据题给热化学方程式计算可得H₂、CO、CH₄的热值大小关系为H₂>CH₄>CO,A错误;反应①△H<0,是放热反应,即反应物的总能量大于生成物的总能量,所以反应①的反应过程可用题图表示,B正确;反应②△H<0,是放热反应,则反应②的逆过程为吸热反应,所以由反应②推出的反应的正确热化学方程式为CO₂(g)=CO(g)+$\frac{1}{2}$O₂(g) △H = 282.6kJ/mol,C错误;反应③表示1molCH₄(g)和足量O₂(g) 完全反应生成二氧化碳气体和液态水放热890.3kJ,D错误。
13. 硫化氢与甲醇合成甲硫醇(CH₃SH)的催化过程如图。下列说法中错误的是 (
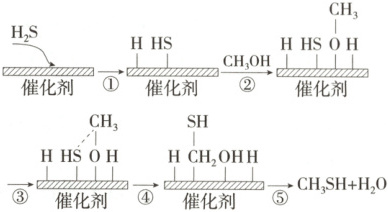
A.过程①、②均需要吸收能量
B.总反应方程式可以表示为$H₂S+CH₃OH\xrightarrow{催化剂}H₂O+CH₃SH$
C.过程④中,只形成了O—H键
D.反应前后催化剂的质量和化学性质没有改变
C
)
A.过程①、②均需要吸收能量
B.总反应方程式可以表示为$H₂S+CH₃OH\xrightarrow{催化剂}H₂O+CH₃SH$
C.过程④中,只形成了O—H键
D.反应前后催化剂的质量和化学性质没有改变
答案:
13.C 由题图可知,过程①、②均为断键过程,需要吸收能量,A项正确;总反应为硫化氢和甲醇生成水和甲硫醇,总反应方程式可以表示为H₂S + CH₃OH$\stackrel{催化剂}{→}$H₂O + CH₃SH,B项正确;由题图可知,过程④中也形成了C - S键,C项错误;催化剂可以改变反应速率,且反应前后催化剂的质量和化学性质没有改变,D项正确。
14. 利用微生物燃料电池进行废水处理,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示,其中M、N为厌氧微生物电极。下列有关叙述错误的是 (
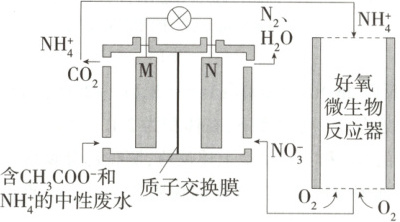
A.负极反应式为CH₃COO⁻-8e⁻+2H₂O=2CO₂↑+7H⁺
B.电池工作时,H⁺由M极区移向N极区
C.相同条件下,M极区生成的CO₂与N极区生成的N₂的体积之比为3:2
D.好氧微生物反应器中发生的反应的离子方程式为NH₄⁺+2O₂=NO₃⁻+2H⁺+H₂O
C
)
A.负极反应式为CH₃COO⁻-8e⁻+2H₂O=2CO₂↑+7H⁺
B.电池工作时,H⁺由M极区移向N极区
C.相同条件下,M极区生成的CO₂与N极区生成的N₂的体积之比为3:2
D.好氧微生物反应器中发生的反应的离子方程式为NH₄⁺+2O₂=NO₃⁻+2H⁺+H₂O
答案:
14.C 据图可知微生物燃料电池中,CH₃COO⁻生成CO₂时失去电子发生氧化反应,则M为原电池的负极,N为原电池的正极。CH₃COO⁻在负极生成CO₂,其电极反应式为CH₃COO⁻ - 8e⁻ + 2H₂O = 2CO₂↑ + 7H⁺,A正确;原电池工作时,阳离子由负极移向正极,即H⁺由M极区移向N极区,B正确;NO₃⁻在正极被还原为N₂,其电极反应式为2NO₃⁻ + 12H⁺ + 10e⁻ = N₂↑ + 6H₂O,由正、负极反应式和得失电子守恒可知,相同条件下,M极区生成的CO₂和N极区生成的N₂的体积之比为5:2,C错误;NH₄⁺在好氧微生物反应器中转化为NO₃⁻,反应的离子方程式为NH₄⁺ + 2O₂ = NO₃⁻ + 2H⁺ + H₂O,D正确。
查看更多完整答案,请扫码查看


