2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
19. (12分)Ⅰ.铅蓄电池的电极材料分别是Pb和PbO₂,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO₂+Pb+2H₂SO₄=2PbSO₄+2H₂O。根据上述情况判断:
(1) 铅蓄电池的负极是
(2) 铅蓄电池工作时,其中电解质溶液的pH
(3) 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得Cl₂ 0.05 mol,电池内理论上消耗的H₂SO₄的物质的量是
Ⅱ.现有以下三种甲烷燃料电池:
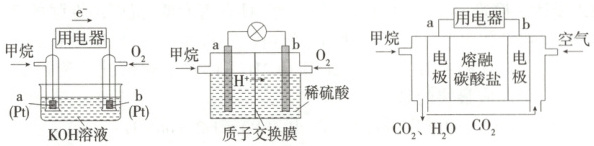
(4) 三种甲烷燃料电池中正极反应物均为
(5) 碱性甲烷燃料电池中,a极反应式为
(6) 酸性甲烷燃料电池中,b极反应式为
(7) 熔融盐甲烷燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO₃²⁻向电极
(1) 铅蓄电池的负极是
Pb
,正极反应式为PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O
。(2) 铅蓄电池工作时,其中电解质溶液的pH
增大
(填“增大”“减小”或“不变”)。(3) 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,若制得Cl₂ 0.05 mol,电池内理论上消耗的H₂SO₄的物质的量是
0.1
mol。Ⅱ.现有以下三种甲烷燃料电池:

(4) 三种甲烷燃料电池中正极反应物均为
O₂
。(5) 碱性甲烷燃料电池中,a极反应式为
CH₄ - 8e⁻ + 10OH⁻ = CO₃²⁻ + 7H₂O
。(6) 酸性甲烷燃料电池中,b极反应式为
O₂ + 4e⁻ + 4H⁺ = 2H₂O
。(7) 熔融盐甲烷燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO₃²⁻向电极
a
(填“a”或“b”)移动。
答案:
19.答案 (除标注外,每空1分)
(1)Pb PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O(2分)
(2)增大
(3)0.1(2分)
(4)O₂
(5)CH₄ - 8e⁻ + 10OH⁻ = CO₃²⁻ + 7H₂O(2分)
(6)O₂ + 4e⁻ + 4H⁺ = 2H₂O(2分)
(7)a
解析
(1)根据铅蓄电池工作时的总反应可知,Pb发生氧化反应转化为PbSO₄,即该电池负极是Pb,正极是PbO₂,正极反应式为PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O。
(2)由总反应知,铅蓄电池工作时,消耗硫酸的同时还生成了水,导致电解质溶液的pH增大。
(3)制得Cl₂ 0.05mol时,转移的电子为0.1mol,而电池中每消耗2molH₂SO₄转移的电子为2mol,那么电池中转移电子0.1mol时理论上消耗H₂SO₄的物质的量是0.1mol。
(4)三种甲烷燃料电池工作时,通入CH₄的电极为负极,通入O₂或空气的电极为正极,且正极反应物均为O₂。
(5)a极通入CH₄,在碱性条件下转化为CO₃²⁻,电极反应式为CH₄ - 8e⁻ + 10OH⁻ = CO₃²⁻ + 7H₂O。
(6)b极通入O₂,在酸性条件下得电子生成H₂O,电极反应式为O₂ + 4e⁻ + 4H⁺ = 2H₂O。
(7)CO₃²⁻为阴离子,电池工作时,它向负极即电极a移动。
(1)Pb PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O(2分)
(2)增大
(3)0.1(2分)
(4)O₂
(5)CH₄ - 8e⁻ + 10OH⁻ = CO₃²⁻ + 7H₂O(2分)
(6)O₂ + 4e⁻ + 4H⁺ = 2H₂O(2分)
(7)a
解析
(1)根据铅蓄电池工作时的总反应可知,Pb发生氧化反应转化为PbSO₄,即该电池负极是Pb,正极是PbO₂,正极反应式为PbO₂ + 2e⁻ + 4H⁺ + SO₄²⁻ = PbSO₄ + 2H₂O。
(2)由总反应知,铅蓄电池工作时,消耗硫酸的同时还生成了水,导致电解质溶液的pH增大。
(3)制得Cl₂ 0.05mol时,转移的电子为0.1mol,而电池中每消耗2molH₂SO₄转移的电子为2mol,那么电池中转移电子0.1mol时理论上消耗H₂SO₄的物质的量是0.1mol。
(4)三种甲烷燃料电池工作时,通入CH₄的电极为负极,通入O₂或空气的电极为正极,且正极反应物均为O₂。
(5)a极通入CH₄,在碱性条件下转化为CO₃²⁻,电极反应式为CH₄ - 8e⁻ + 10OH⁻ = CO₃²⁻ + 7H₂O。
(6)b极通入O₂,在酸性条件下得电子生成H₂O,电极反应式为O₂ + 4e⁻ + 4H⁺ = 2H₂O。
(7)CO₃²⁻为阴离子,电池工作时,它向负极即电极a移动。
20. (13分)某研究性学习小组利用H₂C₂O₄溶液和酸性KMnO₄溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
| 实验序号 | 实验温度/K | 酸性KMnO₄溶液(含硫酸) | H₂C₂O₄溶液 | H₂O | 溶液变为无色所需时间/s |
|---|---|---|---|---|---|
| | | V/mL | c/(mol·L⁻¹) | V/mL | c/(mol·L⁻¹) | V/mL | |
| ① | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t₁ |
| ② | T₁ | 2 | 0.02 | 3 | 0.1 | V₁ | 8 |
| ③ | 313 | 2 | 0.02 | V₂ | 0.1 | 1 | t₂ |
(1) 通过实验①②,可探究
(2) 若t₁<8,则可以得出的结论是
(3) 该反应中有无色无味气体产生且MnO₄⁻被还原为Mn²⁺,写出相应反应的离子方程式:
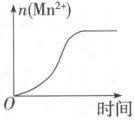
(4) 该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn²⁺)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO₄与草酸之间的反应有某种特殊的作用,则该作用是
| 实验序号 | 实验温度/K | 酸性KMnO₄溶液(含硫酸) | H₂C₂O₄溶液 | H₂O | 溶液变为无色所需时间/s |
|---|---|---|---|---|---|
| | | V/mL | c/(mol·L⁻¹) | V/mL | c/(mol·L⁻¹) | V/mL | |
| ① | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t₁ |
| ② | T₁ | 2 | 0.02 | 3 | 0.1 | V₁ | 8 |
| ③ | 313 | 2 | 0.02 | V₂ | 0.1 | 1 | t₂ |
(1) 通过实验①②,可探究
浓度
的改变对化学反应速率的影响,其中V₁=1
,T₁=293
;通过实验②③
可探究温度变化对化学反应速率的影响。(2) 若t₁<8,则可以得出的结论是
其他条件相同时,增大反应物浓度,反应速率加快
。(3) 该反应中有无色无味气体产生且MnO₄⁻被还原为Mn²⁺,写出相应反应的离子方程式:
2MnO₄⁻ + 5H₂C₂O₄ + 6H⁺ = 2Mn²⁺ + 10CO₂↑ + 8H₂O
。(4) 该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn²⁺)随时间变化的趋势如图所示,并认为造成此种变化的原因是反应体系中的某种粒子对KMnO₄与草酸之间的反应有某种特殊的作用,则该作用是
催化作用
,相应的粒子最可能是Mn²⁺
。
答案:
20.答案 (除标注外,每空2分)
(1)浓度(1分) 1(1分) 293(1分) ②③
(2)其他条件相同时,增大反应物浓度,反应速率加快(其他合理答案也可)
(3)2MnO₄⁻ + 5H₂C₂O₄ + 6H⁺ = 2Mn²⁺ + 10CO₂↑ + 8H₂O
(4)催化作用 Mn²⁺
解析
(1)分析题表中数据知,本实验是探究浓度、温度的变化对化学反应速率的影响。实验中,探究浓度(温度)对化学反应速率的影响时,要确保影响化学反应速率的其他因素相同。实验①②可探究草酸浓度对化学反应速率的影响,故温度应相同,T = 293;为使实验①②中KMnO₄浓度相同,则溶液总体积均应为6mL,故V₁ = 1。实验③温度与另外两组不同,其他条件与实验②相同,故实验②③可探究温度对化学反应速率的影响,因此V₂ = 3。
(2)由题表中实验①②的数据知,在其他条件相同的情况下,增大反应物浓度可加快化学反应速率。
(4)由题图知,反应中存在反应速率明显增大的过程,这表明反应中生成的某种粒子对该反应有催化作用,结合反应前后溶液成分知,该粒子是Mn²⁺。
(1)浓度(1分) 1(1分) 293(1分) ②③
(2)其他条件相同时,增大反应物浓度,反应速率加快(其他合理答案也可)
(3)2MnO₄⁻ + 5H₂C₂O₄ + 6H⁺ = 2Mn²⁺ + 10CO₂↑ + 8H₂O
(4)催化作用 Mn²⁺
解析
(1)分析题表中数据知,本实验是探究浓度、温度的变化对化学反应速率的影响。实验中,探究浓度(温度)对化学反应速率的影响时,要确保影响化学反应速率的其他因素相同。实验①②可探究草酸浓度对化学反应速率的影响,故温度应相同,T = 293;为使实验①②中KMnO₄浓度相同,则溶液总体积均应为6mL,故V₁ = 1。实验③温度与另外两组不同,其他条件与实验②相同,故实验②③可探究温度对化学反应速率的影响,因此V₂ = 3。
(2)由题表中实验①②的数据知,在其他条件相同的情况下,增大反应物浓度可加快化学反应速率。
(4)由题图知,反应中存在反应速率明显增大的过程,这表明反应中生成的某种粒子对该反应有催化作用,结合反应前后溶液成分知,该粒子是Mn²⁺。
查看更多完整答案,请扫码查看


