2025年点石成金金牌夺冠九年级化学全一册人教版辽宁专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年点石成金金牌夺冠九年级化学全一册人教版辽宁专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
12. 科学探究与实践 探究“竹节”中的气体(7分)大熊猫喜欢吃竹子,小川同学想探究竹节中到底有哪些气体。小川同学用随身携带的两个矿泉水瓶,按照图1所示方法收集竹节中的气体,带回实验室研究。
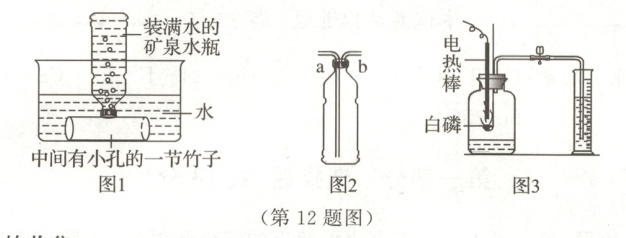
任务一:气体的收集
(1) 图1收集气体的方法叫
任务二:气体的检验
(2) 小川同学将其中一瓶气体注入澄清石灰水,发现矿泉水瓶的外形
任务三:气体的测定
(3) 为了进一步探究竹子里气体成分及含量,同学们进行了如下实验。
① 有同学提出可采用注水的方法将矿泉水瓶(如图2)中收集的气体排入图3集气瓶中,水应从
② 图3实验过程中观察到白磷燃烧,瓶内充满了白烟。冷却后打开弹簧夹,量筒中有水倒吸入集气瓶,说明竹节中肯定含有

请计算出竹节中该气体的含量为

任务一:气体的收集
(1) 图1收集气体的方法叫
排水集气法
,收集前小川同学预先将矿泉水瓶装满水,这样做的目的是排尽矿泉水瓶内空气,使收集到的气体较纯净
。任务二:气体的检验
(2) 小川同学将其中一瓶气体注入澄清石灰水,发现矿泉水瓶的外形
变瘪
(填实验现象),石灰水变浑浊,则竹节中含有CO₂
。任务三:气体的测定
(3) 为了进一步探究竹子里气体成分及含量,同学们进行了如下实验。
① 有同学提出可采用注水的方法将矿泉水瓶(如图2)中收集的气体排入图3集气瓶中,水应从
a
(填“a”或“b”)导管注入。② 图3实验过程中观察到白磷燃烧,瓶内充满了白烟。冷却后打开弹簧夹,量筒中有水倒吸入集气瓶,说明竹节中肯定含有
氧气(或O₂)
。实验测得数据如下表:
请计算出竹节中该气体的含量为
9.9%
(结果精确到$0.1\%$)。
答案:
12.(每空1分)
任务一:
(1)排水集气法 排尽矿泉水瓶内空气,使收集到的气体较纯净
任务二:
(2)变瘪 CO₂
任务三:
(3)①a ②氧气(或O₂) 9.9%
【解析】任务三:
(3)②白磷与氧气反应生成五氧化二磷,集气瓶中氧气被消耗,压强减小。量筒中的水进入集气瓶中,即进入集气瓶中水的体积等于消耗的氧气的体积,所以氧气的含量为$\frac{90 mL - 45.5 mL}{450 mL}≈9.9%。$
任务一:
(1)排水集气法 排尽矿泉水瓶内空气,使收集到的气体较纯净
任务二:
(2)变瘪 CO₂
任务三:
(3)①a ②氧气(或O₂) 9.9%
【解析】任务三:
(3)②白磷与氧气反应生成五氧化二磷,集气瓶中氧气被消耗,压强减小。量筒中的水进入集气瓶中,即进入集气瓶中水的体积等于消耗的氧气的体积,所以氧气的含量为$\frac{90 mL - 45.5 mL}{450 mL}≈9.9%。$
13. 科学探究与实践 氧气的制取及催化剂的选择(11分)实验是化学探究的重要途径。
(一) 氧气的制取
某化学兴趣小组的同学利用图1装置进行氧气的制取,请回答下列问题。
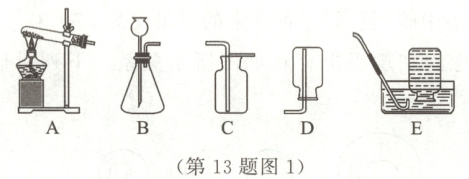
(1) 实验室选用装置A作为高锰酸钾制取氧气的发生装置,反应的化学方程式为
(2) 用过氧化氢和二氧化锰的混合物制取氧气的化学方程式为
(二) 探究制取氧气的催化剂
化学兴趣小组的同学提出了疑问:是否只有二氧化锰能催化过氧化氢分解?为得出结论,进行了如下实验。
【查阅资料】多种物质都可催化过氧化氢分解,如${MnO_{2}}$、${CuSO_{4}}$等。
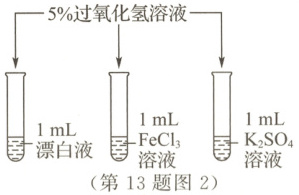
该实验小组的同学探究漂白液(主要成分是$NaClO$和$NaCl$)、${FeCl_{3}}$、${K_{2}SO_{4}}$能否催化过氧化氢分解。
【设计实验】如图2所示,分别向三支试管中多次加入$5\%$过氧化氢溶液,每次$2\ mL$,若有气泡产生,则将
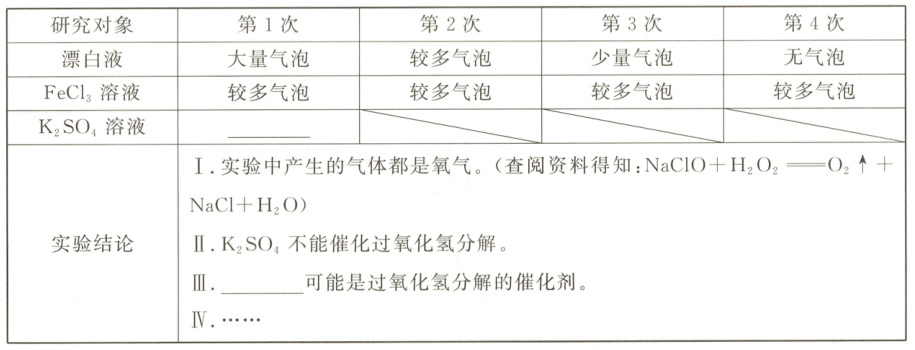
(3) 请补全上表。
(4) 下列物质中,也可能是过氧化氢分解的催化剂的是
A. ${CuCl_{2}}$
B. ${Fe_{2}(SO_{4})_{3}}$
C. ${Na_{2}SO_{4}}$
D. $KCl$
(三) 实验方案设计
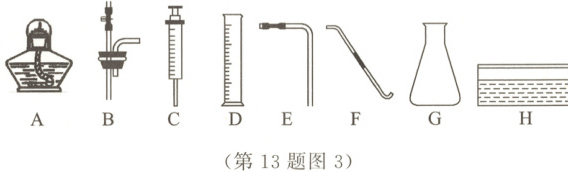
(5) 探究不同催化剂催化效果的实验方案:将等体积$5\%$过氧化氢溶液加到不同催化剂中,比较用排水法收集$50\ mL$氧气的快慢。请从图3中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是
(四) 生活中的“增氧剂”
(6) 过氧化钙(${CaO_{2}}$)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。该兴趣小组的同学购得一种过氧化钙产品(杂质不含钙元素),标签如图4所示。最少需要

(一) 氧气的制取
某化学兴趣小组的同学利用图1装置进行氧气的制取,请回答下列问题。

(1) 实验室选用装置A作为高锰酸钾制取氧气的发生装置,反应的化学方程式为
$2KMnO₄\overset{\triangle}{=}K₂MnO₄+MnO₂+O₂↑$
,试管口放一团棉花的作用是防止粉末状物质进入导管
;加热$15.8\ g$高锰酸钾,理论上生成氧气的质量为1.6
$g$。(2) 用过氧化氢和二氧化锰的混合物制取氧气的化学方程式为
$2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑$
,为了获得干燥的氧气,应选用的收集装置是C
(填字母序号)。(二) 探究制取氧气的催化剂
化学兴趣小组的同学提出了疑问:是否只有二氧化锰能催化过氧化氢分解?为得出结论,进行了如下实验。
【查阅资料】多种物质都可催化过氧化氢分解,如${MnO_{2}}$、${CuSO_{4}}$等。
该实验小组的同学探究漂白液(主要成分是$NaClO$和$NaCl$)、${FeCl_{3}}$、${K_{2}SO_{4}}$能否催化过氧化氢分解。
【设计实验】如图2所示,分别向三支试管中多次加入$5\%$过氧化氢溶液,每次$2\ mL$,若有气泡产生,则将
带火星的木条
伸入试管,检验是否有氧气生成,结果如下表。

(3) 请补全上表。
(4) 下列物质中,也可能是过氧化氢分解的催化剂的是
AB
(填字母序号)。A. ${CuCl_{2}}$
B. ${Fe_{2}(SO_{4})_{3}}$
C. ${Na_{2}SO_{4}}$
D. $KCl$
(三) 实验方案设计
(5) 探究不同催化剂催化效果的实验方案:将等体积$5\%$过氧化氢溶液加到不同催化剂中,比较用排水法收集$50\ mL$氧气的快慢。请从图3中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是
AE
(填字母序号)。
(四) 生活中的“增氧剂”
(6) 过氧化钙(${CaO_{2}}$)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。该兴趣小组的同学购得一种过氧化钙产品(杂质不含钙元素),标签如图4所示。最少需要
80.0
$g$的该过氧化钙产品才能与$100.0\ g$碳酸钙(${CaCO_{3}}$)含钙量相当。
答案:
13.(每空1分)
(一$)(1)2KMnO₄\overset{\triangle}{=}K₂MnO₄+MnO₂+O₂↑ $防止粉末状物质进入导管
1.6
$(2)2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑ C$
(二)【设计实验】带火星的木条
(3)无气泡 氯化铁
(4)AB
(三)
(5)AE
(6)80.0
【解析】(一)
(1)设理论上生成氧气的质量为x。
$2KMnO₄\overset{\triangle}{=}K₂MnO₄+MnO₂+O₂↑$
316 32
15.8 g x
$\frac{316}{32}=\frac{15.8 g}{x} x=1.6 g$
所以理论上生成氧气的质量为1.6 g。
(二)
(4)CuSO₄可催化过氧化氢分解,而当加入K₂SO₄后无气泡产生,说明起到催化作用的粒子是Cu²⁺,不是K⁺和SO₄²⁻,故A正确;漂白粉中含有Na⁺、Cl⁻,加入漂白粉不能使过氧化氢持续分解,所以Na⁺、Cl⁻不起催化作用,故C、D错误;FeCl₃可能是过氧化氢分解的催化剂,即可能起催化作用的粒子是Fe³⁺,故B正确。
(四)
(6)100.0 g碳酸钙中钙元素的质量为$100.0 g×\frac{40}{100}=40.0 g。$
最少需要该过氧化钙产品的质量为40.0 g÷50%=80.0 g。
所以最少需要80.0 g的该过氧化钙产品与100.0 g碳酸钙(CaCO₃)含钙量相当。
(一$)(1)2KMnO₄\overset{\triangle}{=}K₂MnO₄+MnO₂+O₂↑ $防止粉末状物质进入导管
1.6
$(2)2H₂O₂\overset{MnO₂}{=}2H₂O+O₂↑ C$
(二)【设计实验】带火星的木条
(3)无气泡 氯化铁
(4)AB
(三)
(5)AE
(6)80.0
【解析】(一)
(1)设理论上生成氧气的质量为x。
$2KMnO₄\overset{\triangle}{=}K₂MnO₄+MnO₂+O₂↑$
316 32
15.8 g x
$\frac{316}{32}=\frac{15.8 g}{x} x=1.6 g$
所以理论上生成氧气的质量为1.6 g。
(二)
(4)CuSO₄可催化过氧化氢分解,而当加入K₂SO₄后无气泡产生,说明起到催化作用的粒子是Cu²⁺,不是K⁺和SO₄²⁻,故A正确;漂白粉中含有Na⁺、Cl⁻,加入漂白粉不能使过氧化氢持续分解,所以Na⁺、Cl⁻不起催化作用,故C、D错误;FeCl₃可能是过氧化氢分解的催化剂,即可能起催化作用的粒子是Fe³⁺,故B正确。
(四)
(6)100.0 g碳酸钙中钙元素的质量为$100.0 g×\frac{40}{100}=40.0 g。$
最少需要该过氧化钙产品的质量为40.0 g÷50%=80.0 g。
所以最少需要80.0 g的该过氧化钙产品与100.0 g碳酸钙(CaCO₃)含钙量相当。
查看更多完整答案,请扫码查看


