2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第51页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
5.(2024·全国甲卷,15分)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯($C_3H_6$)的研究所获得的部分数据如下。回答下列问题:
(1)已知如下热化学方程式:
$CH_4(g)+Br_2(g)=CH_3Br(g)+HBr(g)$ $\triangle H_1=-29kJ·mol⁻¹$
$3CH_3Br(g)=C_3H_6(g)+3HBr(g)$ $\triangle H_2=+20kJ·mol⁻¹$
计算反应$3CH_4(g)+3Br_2(g)=C_3H_6(g)+6HBr(g)$的$\triangle H=$
(2)$CH_4$与$Br_2$反应生成$CH_3Br$,部分$CH_3Br$会进一步溴化。将$8mmol CH_4$和$8mmol Br_2$通人密闭容器,平衡时,$n(CH_4)、n(CH_3Br)$与温度的关系见下图(假设反应后的含碳物质只有$CH_4、CH_3Br$和$CH_2Br_2$)。
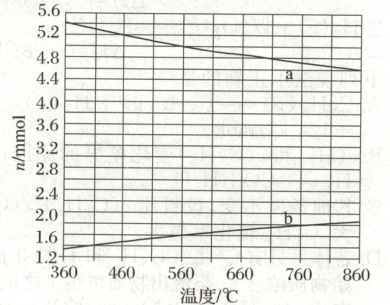
(ⅰ)图中$CH_3Br$的曲线是
(填“a”或“b”)。
(ⅱ)$560^∘C$时,$CH_4$的转化率$\alpha=$ ,$n(HBr)=$
(ⅲ)$560^∘C$时,反应$CH_3Br(g)+Br_2(g)=CH_2Br_2(g)+HBr(g)$的平衡常数$K=$
(3)少量$I_2$可提高生成$CH_3Br$的选择性。$500^∘C$时,分别在有$I_2$和无$I_2$的条件下,将$8mmol CH_4$和$8mmol Br_2$通人密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。
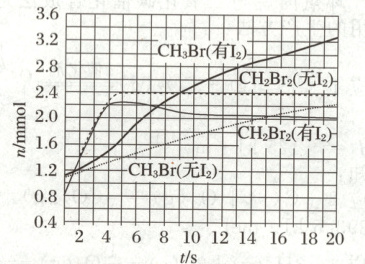
(ⅰ)在11~19s之间,有$I_2$和无$I_2$时$CH_3Br$的生成速率之比$\frac {v(有I_2)} {v(无I_2)}=$
(ⅱ)从图中找出$I_2$提高了$CH_3Br$选择性的证据:
。
(ⅲ)研究表明,$I_2$参与反应的可能机理如下:
①$I_2(g)⇌·I(g)+·I(g)$
②$·I(g)+CH_2Br_2(g)=IBr(g)+·CH_2Br(g)$
③$CH_2Br(g)+HBr(g)=CH_3Br(g)+·Br(g)$
④$·Br(g)+CH_4(g)=HBr(g)+·CH_3(g)$
⑤$CH_3(g)+IBr(g)=CH_3Br(g)+·I(g)$
⑥$·I(g)+·I(g)=I_2(g)$
根据上述机理,分析$I_2$提高$CH_3Br$选择性的原因:
。
(1)已知如下热化学方程式:
$CH_4(g)+Br_2(g)=CH_3Br(g)+HBr(g)$ $\triangle H_1=-29kJ·mol⁻¹$
$3CH_3Br(g)=C_3H_6(g)+3HBr(g)$ $\triangle H_2=+20kJ·mol⁻¹$
计算反应$3CH_4(g)+3Br_2(g)=C_3H_6(g)+6HBr(g)$的$\triangle H=$
-67
kJ·mol⁻¹。(2)$CH_4$与$Br_2$反应生成$CH_3Br$,部分$CH_3Br$会进一步溴化。将$8mmol CH_4$和$8mmol Br_2$通人密闭容器,平衡时,$n(CH_4)、n(CH_3Br)$与温度的关系见下图(假设反应后的含碳物质只有$CH_4、CH_3Br$和$CH_2Br_2$)。

(ⅰ)图中$CH_3Br$的曲线是
a
(填“a”或“b”)。
(ⅱ)$560^∘C$时,$CH_4$的转化率$\alpha=$ ,$n(HBr)=$
7.8
mmol。80%
(ⅲ)$560^∘C$时,反应$CH_3Br(g)+Br_2(g)=CH_2Br_2(g)+HBr(g)$的平衡常数$K=$
10.92
。(3)少量$I_2$可提高生成$CH_3Br$的选择性。$500^∘C$时,分别在有$I_2$和无$I_2$的条件下,将$8mmol CH_4$和$8mmol Br_2$通人密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。

(ⅰ)在11~19s之间,有$I_2$和无$I_2$时$CH_3Br$的生成速率之比$\frac {v(有I_2)} {v(无I_2)}=$
1.5
。(ⅱ)从图中找出$I_2$提高了$CH_3Br$选择性的证据:
有$I_2$时,$CH_3Br$的量明显提高,$CH_2Br_2$的量降低,且约7.5 s后,体系中$CH_3Br$的量高于$CH_2Br_2$的量
。
(ⅲ)研究表明,$I_2$参与反应的可能机理如下:
①$I_2(g)⇌·I(g)+·I(g)$
②$·I(g)+CH_2Br_2(g)=IBr(g)+·CH_2Br(g)$
③$CH_2Br(g)+HBr(g)=CH_3Br(g)+·Br(g)$
④$·Br(g)+CH_4(g)=HBr(g)+·CH_3(g)$
⑤$CH_3(g)+IBr(g)=CH_3Br(g)+·I(g)$
⑥$·I(g)+·I(g)=I_2(g)$
根据上述机理,分析$I_2$提高$CH_3Br$选择性的原因:
$I_2$产生的·I可将反应后的含碳物质$CH_2Br_2$经过反应②、③转化为$CH_3Br$;而反应过程中生成的·Br可继续与$CH_4$经过反应④、⑤又生成$CH_3Br$
。
答案:
5.解析 盖斯定律、转化率、平衡常数、化学平衡移动
(1)根据盖斯定律,目标反应=第一个反应×3+第二个反应,则$\Delta H = 3 × \Delta H_1 + \Delta H_2 = 3 × (-29 kJ · mol^{-1}) + 20 kJ · mol^{-1} = -67 kJ · mol^{-1} $。
(2)(ⅰ)由$\Delta H_1 < 0$,升高温度,该反应的平衡逆向移动,$n(CH_4)$增大,$n(CH_3Br)$减小,故图中$CH_3Br$的曲线是a。 (ⅱ)根据题图可知,560℃时,平衡时$n(CH_4) = 1.6 mmol$,$n(CH_3Br) = 5.0 mmol$,则$CH_4$的转化率$\alpha = \frac{8 mmol - 1.6 mmol}{8 mmol} × 100\% = 80\%$,$CH_4$的转化量为6.4 mmol,故进一步溴化的$CH_3Br$的物质的量为$(6.4 - 5.0) mmol = 1.4 mmol$,则$CH_3Br$进一步溴化生成的$HBr$的量为1.4 mmol,故$n(HBr) = 6.4 mmol + 1.4 mmol = 7.8 mmol$。 (ⅲ)假设$CH_4$与$Br_2$反应生成$CH_3Br$平衡后$CH_3Br$再进一步溴化,根据题图中的数据,并结合(ⅱ)的分析,列三段式:
$ \begin{array}{c c c c c} & CH_3Br(g) & + & Br_2(g) & \rightleftharpoons & CH_2Br_2(g) & + & HBr(g) \\ 起始量/mmol & 6.4 & & 1.6 & & 0 & & 6.4 \\ 转化量/mmol & 1.4 & & 1.4 & & 1.4 & & 1.4 \\ 平衡量/mmol & 5.0 & & 0.2 & & 1.4 & & 7.8 \\ \end{array} $
该反应为气体分子数不变的反应,可用物质的量来计算平衡常数,则$K = \frac{7.8 × 1.4}{5.0 × 0.2} = 10.92$。
(3)(ⅰ)根据图中关于$CH_3Br$的数据可得,$v(有I_2) = \frac{(3.2 - 2.6) mmol}{(19 - 11) s} = 0.075 mmol · s^{-1}$,$v(无I_2) = \frac{(2.2 - 1.8) mmol}{(19 - 11) s} = 0.05 mmol · s^{-1}$,则$\frac{v(有I_2)}{v(无I_2)} = \frac{0.075 mmol · s^{-1}}{0.05 mmol · s^{-1}} = 1.5$。 (ⅱ)由题图知,有$I_2$时,$CH_3Br$的量明显提高,$CH_2Br_2$的量降低,且约7.5 s后,体系中$CH_3Br$的量高于$CH_2Br_2$的量,故$I_2$提高了$CH_3Br$的选择性。 (ⅲ)$I_2$产生的·I可将反应后的含碳物质$CH_2Br_2$经过反应②、③转化为$CH_3Br$;而反应过程中生成的·Br可继续与$CH_4$经过反应④、⑤生成$CH_3Br$,提高了生成的$CH_3Br$的量,减少了$CH_2Br_2$的量,从而提高$CH_3Br$选择性。
答案
(1)$-67$
(2)(ⅰ)a (ⅱ)80% 7.8 (ⅲ)10.92
(3)(ⅰ)1.5 (ⅱ)有$I_2$时,$CH_3Br$的量明显提高,$CH_2Br_2$的量降低,且约7.5 s后,体系中$CH_3Br$的量高于$CH_2Br_2$的量 (ⅲ)$I_2$产生的·I可将反应后的含碳物质$CH_2Br_2$经过反应②、③转化为$CH_3Br$;而反应过程中生成的·Br可继续与$CH_4$经过反应④、⑤又生成$CH_3Br$
(1)根据盖斯定律,目标反应=第一个反应×3+第二个反应,则$\Delta H = 3 × \Delta H_1 + \Delta H_2 = 3 × (-29 kJ · mol^{-1}) + 20 kJ · mol^{-1} = -67 kJ · mol^{-1} $。
(2)(ⅰ)由$\Delta H_1 < 0$,升高温度,该反应的平衡逆向移动,$n(CH_4)$增大,$n(CH_3Br)$减小,故图中$CH_3Br$的曲线是a。 (ⅱ)根据题图可知,560℃时,平衡时$n(CH_4) = 1.6 mmol$,$n(CH_3Br) = 5.0 mmol$,则$CH_4$的转化率$\alpha = \frac{8 mmol - 1.6 mmol}{8 mmol} × 100\% = 80\%$,$CH_4$的转化量为6.4 mmol,故进一步溴化的$CH_3Br$的物质的量为$(6.4 - 5.0) mmol = 1.4 mmol$,则$CH_3Br$进一步溴化生成的$HBr$的量为1.4 mmol,故$n(HBr) = 6.4 mmol + 1.4 mmol = 7.8 mmol$。 (ⅲ)假设$CH_4$与$Br_2$反应生成$CH_3Br$平衡后$CH_3Br$再进一步溴化,根据题图中的数据,并结合(ⅱ)的分析,列三段式:
$ \begin{array}{c c c c c} & CH_3Br(g) & + & Br_2(g) & \rightleftharpoons & CH_2Br_2(g) & + & HBr(g) \\ 起始量/mmol & 6.4 & & 1.6 & & 0 & & 6.4 \\ 转化量/mmol & 1.4 & & 1.4 & & 1.4 & & 1.4 \\ 平衡量/mmol & 5.0 & & 0.2 & & 1.4 & & 7.8 \\ \end{array} $
该反应为气体分子数不变的反应,可用物质的量来计算平衡常数,则$K = \frac{7.8 × 1.4}{5.0 × 0.2} = 10.92$。
(3)(ⅰ)根据图中关于$CH_3Br$的数据可得,$v(有I_2) = \frac{(3.2 - 2.6) mmol}{(19 - 11) s} = 0.075 mmol · s^{-1}$,$v(无I_2) = \frac{(2.2 - 1.8) mmol}{(19 - 11) s} = 0.05 mmol · s^{-1}$,则$\frac{v(有I_2)}{v(无I_2)} = \frac{0.075 mmol · s^{-1}}{0.05 mmol · s^{-1}} = 1.5$。 (ⅱ)由题图知,有$I_2$时,$CH_3Br$的量明显提高,$CH_2Br_2$的量降低,且约7.5 s后,体系中$CH_3Br$的量高于$CH_2Br_2$的量,故$I_2$提高了$CH_3Br$的选择性。 (ⅲ)$I_2$产生的·I可将反应后的含碳物质$CH_2Br_2$经过反应②、③转化为$CH_3Br$;而反应过程中生成的·Br可继续与$CH_4$经过反应④、⑤生成$CH_3Br$,提高了生成的$CH_3Br$的量,减少了$CH_2Br_2$的量,从而提高$CH_3Br$选择性。
答案
(1)$-67$
(2)(ⅰ)a (ⅱ)80% 7.8 (ⅲ)10.92
(3)(ⅰ)1.5 (ⅱ)有$I_2$时,$CH_3Br$的量明显提高,$CH_2Br_2$的量降低,且约7.5 s后,体系中$CH_3Br$的量高于$CH_2Br_2$的量 (ⅲ)$I_2$产生的·I可将反应后的含碳物质$CH_2Br_2$经过反应②、③转化为$CH_3Br$;而反应过程中生成的·Br可继续与$CH_4$经过反应④、⑤又生成$CH_3Br$
查看更多完整答案,请扫码查看


