2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第120页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
1.(2025·山东卷,2分)物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是(

A
)
答案:
A
2.(2022·山东卷)$\mathrm{AlN}$、$\mathrm{GaN}$属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在$\mathrm{N-Al}$键、$\mathrm{N-Ga}$键。下列说法错误的是(
A.$\mathrm{GaN}$的熔点高于$\mathrm{AlN}$
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取$\mathrm{sp^3}$杂化
D.晶体中所有原子的配位数均相同
A
)A.$\mathrm{GaN}$的熔点高于$\mathrm{AlN}$
B.晶体中所有化学键均为极性键
C.晶体中所有原子均采取$\mathrm{sp^3}$杂化
D.晶体中所有原子的配位数均相同
答案:
A
3.(2021·全国甲卷,15分)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。$\mathrm{Si}$的价电子层的电子排布式为
含$s$、$p$、$d$轨道的杂化类型有:①$\mathrm{dsp^2}$、②$\mathrm{sp^3d}$、③$\mathrm{sp^3d^2}$,中间体$\mathrm{SiCl_4(H_2O)}$中$\mathrm{Si}$采取的杂化类型为
(2)$\mathrm{CO_2}$分子中存在
(3)甲醇的沸点($64.7°\mathrm{C}$)介于水($100°\mathrm{C}$)和甲硫醇($\mathrm{CH_3SH}$,$7.6°\mathrm{C}$)之间,其原因是

(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为$\mathrm{ZnO/ZrO_2}$固溶体。四方$\mathrm{ZrO_2}$晶胞如右图所示。$\mathrm{Zr^{4+}}$离子在晶胞中的配位数是

(1)太阳能电池板主要材料为单晶硅或多晶硅。$\mathrm{Si}$的价电子层的电子排布式为
$3s^{2}3p^{2}$
;单晶硅的晶体类型为原子晶体(或共价晶体)
。$\mathrm{SiCl_4}$是生产高纯硅的前驱体,其中$\mathrm{Si}$采取的杂化类型为$sp^{3}$
。$\mathrm{SiCl_4}$可发生水解反应,机理如下:含$s$、$p$、$d$轨道的杂化类型有:①$\mathrm{dsp^2}$、②$\mathrm{sp^3d}$、③$\mathrm{sp^3d^2}$,中间体$\mathrm{SiCl_4(H_2O)}$中$\mathrm{Si}$采取的杂化类型为
②
(填标号)。(2)$\mathrm{CO_2}$分子中存在
2
个$\sigma$键和2
个$\pi$键。(3)甲醇的沸点($64.7°\mathrm{C}$)介于水($100°\mathrm{C}$)和甲硫醇($\mathrm{CH_3SH}$,$7.6°\mathrm{C}$)之间,其原因是
甲醇和水均能形成分子间氢键,而甲硫醇不能,且水比甲醇的氢键多
。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为$\mathrm{ZnO/ZrO_2}$固溶体。四方$\mathrm{ZrO_2}$晶胞如右图所示。$\mathrm{Zr^{4+}}$离子在晶胞中的配位数是
8
,晶胞参数为$a\mathrm{pm}$、$a\mathrm{pm}$、$c\mathrm{pm}$,该晶体密度为$\frac{4×91 + 8×16}{N_{A}a^{2}c×10^{-30}}$
$\mathrm{g· cm^{-3}}$(写出表达式)。在$\mathrm{ZrO_2}$中掺杂少量$\mathrm{ZnO}$后形成的催化剂,化学式可表示为$\mathrm{Zn_xZr_{1-x}O_y}$,则$y=$$2 - x$
(用$x$表达)。
答案:
(1)基态硅原子M层有4个电子,分别填充于3s和3p 能级轨道中,则基态硅原子价电子排布式为$3s^{2}3p^{2}$。单质硅熔、沸点高,硬度大,是原子晶体。$SiCl_{4}$的中心原子硅原子周围有4对成键电子对,则Si采取$sp^{3}$杂化。由中间体$SiCl_{4}(H_{2}O)$的结构可知,Si原子周围有5对成键电子对,故该杂化轨道含1个s杂化轨道、3个p杂化轨道和1个d杂化轨道,则Si采取的杂化类型为$sp^{3}d$。
(2)$CO_{2}$分子的结构为$O=C=O$,则1个$CO_{2}$分子中含2个σ键和2个π键。
(3)甲醇的结构简式是$CH_{3}OH$,1个甲醇分子可形成1个分子间氢键,而1个$H_{2}O$分子可形成2个分子间氢键,水中氢键比例比甲醇高,故水的沸点比甲醇高,甲硫醇中不存在氢键,其沸点最低。
(4)以$ZrO_{2}$晶胞结构的上面面心的$Zr^{4+}$为研究对象,将晶体结构向上由1个晶胞延长为2个晶胞,可观察到与该$Zr^{4+}$距离最近的$O^{2-}$有8个,则$Zr^{4+}$的配位数为8。该晶胞中含8个$O^{2-}$,$Zr^{4+}$个数为$8×\frac{1}{8}+6×\frac{1}{2}=4$个,则1个晶胞的质量为$\frac{4×91 + 8×16}{N_{A}}g$,1个晶胞的体积为$a^{2}c×10^{-30}cm^{3}$,则该晶体的密度为$\frac{4×91 + 8×16}{N_{A}a^{2}c×10^{-30}}g· cm^{-3}$。该晶体中,Zr为+4价,Zn为+2价,O为-2价,由化合物中各元素化合价代数和为0可得,$2x + 4×(1 - x)-2y = 0$,解得$y = 2 - x$。
答案
(1)$3s^{2}3p^{2}$ 原子晶体(或共价晶体) $sp^{3}d$
(2)2 2
(3)甲醇和水均能形成分子间氢键,而甲硫醇不能,且水比甲醇的氢键多
(4)8 $\frac{4×91 + 8×16}{N_{A}a^{2}c×10^{-30}}$ $2 - x$
(1)基态硅原子M层有4个电子,分别填充于3s和3p 能级轨道中,则基态硅原子价电子排布式为$3s^{2}3p^{2}$。单质硅熔、沸点高,硬度大,是原子晶体。$SiCl_{4}$的中心原子硅原子周围有4对成键电子对,则Si采取$sp^{3}$杂化。由中间体$SiCl_{4}(H_{2}O)$的结构可知,Si原子周围有5对成键电子对,故该杂化轨道含1个s杂化轨道、3个p杂化轨道和1个d杂化轨道,则Si采取的杂化类型为$sp^{3}d$。
(2)$CO_{2}$分子的结构为$O=C=O$,则1个$CO_{2}$分子中含2个σ键和2个π键。
(3)甲醇的结构简式是$CH_{3}OH$,1个甲醇分子可形成1个分子间氢键,而1个$H_{2}O$分子可形成2个分子间氢键,水中氢键比例比甲醇高,故水的沸点比甲醇高,甲硫醇中不存在氢键,其沸点最低。
(4)以$ZrO_{2}$晶胞结构的上面面心的$Zr^{4+}$为研究对象,将晶体结构向上由1个晶胞延长为2个晶胞,可观察到与该$Zr^{4+}$距离最近的$O^{2-}$有8个,则$Zr^{4+}$的配位数为8。该晶胞中含8个$O^{2-}$,$Zr^{4+}$个数为$8×\frac{1}{8}+6×\frac{1}{2}=4$个,则1个晶胞的质量为$\frac{4×91 + 8×16}{N_{A}}g$,1个晶胞的体积为$a^{2}c×10^{-30}cm^{3}$,则该晶体的密度为$\frac{4×91 + 8×16}{N_{A}a^{2}c×10^{-30}}g· cm^{-3}$。该晶体中,Zr为+4价,Zn为+2价,O为-2价,由化合物中各元素化合价代数和为0可得,$2x + 4×(1 - x)-2y = 0$,解得$y = 2 - x$。
答案
(1)$3s^{2}3p^{2}$ 原子晶体(或共价晶体) $sp^{3}d$
(2)2 2
(3)甲醇和水均能形成分子间氢键,而甲硫醇不能,且水比甲醇的氢键多
(4)8 $\frac{4×91 + 8×16}{N_{A}a^{2}c×10^{-30}}$ $2 - x$
1.(2025·黑吉辽蒙卷,3分)$\mathrm{Na_xWO_3}$晶体因$x$变化形成空位而导致颜色各异,当$0.44\leq x\leq0.95$时,其立方晶胞结构如图。设$N_\mathrm{A}$为阿伏加德罗常数的值,下列说法错误的是(
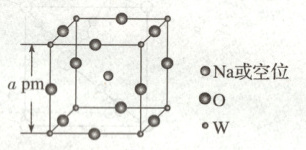
A.与$\mathrm{W}$最近且等距的$\mathrm{O}$有6个
B.$x$增大时,$\mathrm{W}$的平均价态升高
C.密度为$\frac{243.5×10^{30}}{a^3· N_\mathrm{A}}\mathrm{g· cm^{-3}}$时,$x=0.5$
D.空位数不同,吸收的可见光波长不同
B
)
A.与$\mathrm{W}$最近且等距的$\mathrm{O}$有6个
B.$x$增大时,$\mathrm{W}$的平均价态升高
C.密度为$\frac{243.5×10^{30}}{a^3· N_\mathrm{A}}\mathrm{g· cm^{-3}}$时,$x=0.5$
D.空位数不同,吸收的可见光波长不同
答案:
B
2.(2024·吉林卷,3分)某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是(
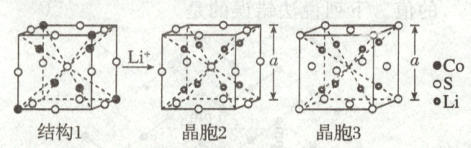
A.结构1钴硫化物的化学式为$\mathrm{Co_9S_8}$
B.晶胞2中$\mathrm{S}$与$\mathrm{S}$的最短距离为$\frac{\sqrt{3}}{2}a$
C.晶胞2中距$\mathrm{Li}$最近的$\mathrm{S}$有4个
D.晶胞2和晶胞3表示同一晶体
B
)
A.结构1钴硫化物的化学式为$\mathrm{Co_9S_8}$
B.晶胞2中$\mathrm{S}$与$\mathrm{S}$的最短距离为$\frac{\sqrt{3}}{2}a$
C.晶胞2中距$\mathrm{Li}$最近的$\mathrm{S}$有4个
D.晶胞2和晶胞3表示同一晶体
答案:
B
查看更多完整答案,请扫码查看


