2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第118页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
6.(2023·辽宁卷,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。
下列说法错误的是(
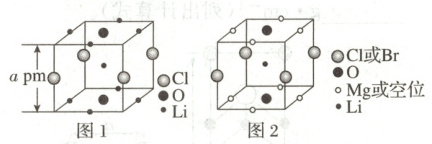
A.图1晶体密度为$72.5/(N_\mathrm{A}× a^3×10^{-30})\mathrm{g· cm^{-3}}$
B.图1中$\mathrm{O}$原子的配位数为6
C.图2表示的化学式为$\mathrm{LiMg_2OCl_xBr_{1-x}}$
D.$\mathrm{Mg^{2+}}$取代产生的空位有利于$\mathrm{Li^+}$传导
下列说法错误的是(
C
)
A.图1晶体密度为$72.5/(N_\mathrm{A}× a^3×10^{-30})\mathrm{g· cm^{-3}}$
B.图1中$\mathrm{O}$原子的配位数为6
C.图2表示的化学式为$\mathrm{LiMg_2OCl_xBr_{1-x}}$
D.$\mathrm{Mg^{2+}}$取代产生的空位有利于$\mathrm{Li^+}$传导
答案:
C
7.(2023·湖北卷,3分)镧$\mathrm{La}$和$\mathrm{H}$可以形成一系列晶体材料$\mathrm{LaH_n}$,在储氢和超导等领域具有重要应用。$\mathrm{LaH_n}$属于立方晶系,晶胞结构和参数如图所示。高压下,$\mathrm{LaH_2}$中的每个$\mathrm{H}$结合4个$\mathrm{H}$形成类似$\mathrm{CH_4}$的结构,即得到晶体$\mathrm{LaH_x}$。下列说法错误的是(

A.$\mathrm{LaH_2}$晶体中$\mathrm{La}$的配位数为8
B.晶体中$\mathrm{H}$和$\mathrm{H}$的最短距离:$\mathrm{LaH_2}>\mathrm{LaH_x}$
C.在$\mathrm{LaH_x}$晶胞中,$\mathrm{H}$形成一个顶点数为40的闭合多面体笼
D.$\mathrm{LaH_x}$单位体积中含氢质量的计算式为$\frac{40}{(4.84×10^{-8})^3×6.02×10^{23}}\mathrm{g· cm^{-3}}$
C
)
A.$\mathrm{LaH_2}$晶体中$\mathrm{La}$的配位数为8
B.晶体中$\mathrm{H}$和$\mathrm{H}$的最短距离:$\mathrm{LaH_2}>\mathrm{LaH_x}$
C.在$\mathrm{LaH_x}$晶胞中,$\mathrm{H}$形成一个顶点数为40的闭合多面体笼
D.$\mathrm{LaH_x}$单位体积中含氢质量的计算式为$\frac{40}{(4.84×10^{-8})^3×6.02×10^{23}}\mathrm{g· cm^{-3}}$
答案:
C
8.(2022·山东卷)工业上以$\mathrm{SrSO_4(s)}$为原料生产$\mathrm{SrCO_3(s)}$,对其工艺条件进行研究。现有含$\mathrm{SrCO_3(s)}$的$0.1\mathrm{mol· L^{-1}}$、$1.0\mathrm{mol· L^{-1}}\mathrm{Na_2CO_3}$溶液,含$\mathrm{SrSO_4(s)}$的$0.1\mathrm{mol· L^{-1}}$、$1.0\mathrm{mol· L^{-1}}\mathrm{Na_2SO_4}$溶液。在一定$\mathrm{pH}$范围内,四种溶液中$\lg\frac{[c(\mathrm{Sr^{2+}})]}{\mathrm{mol^{-1}· L^{-1}}}$随$\mathrm{pH}$的变化关系如图所示。下列说法错误的是(
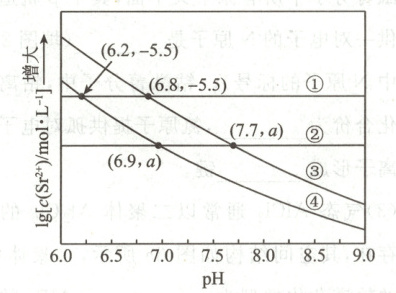
A.反应$\mathrm{SrSO_4(s)+CO_3^{2-}\rightleftharpoons SrCO_3(s)+SO_4^{2-}}$的平衡常数$K=\frac{K_{sp}(\mathrm{SrSO_4})}{K_{sp}(\mathrm{SrCO_3})}$
B.$a=-6.5$
C.曲线④代表含$\mathrm{SrCO_3(s)}$的$1.0\mathrm{mol· L^{-1}}\mathrm{NaCO_3}$溶液的变化曲线
D.对含$\mathrm{SrSO_4(s)}$且$\mathrm{Na_2SO_4}$和$\mathrm{Na_2CO_3}$初始浓度均为$1.0\mathrm{mol· L^{-1}}$的混合溶液,$\mathrm{pH\geq7.7}$时才发生沉淀转化
D
)
A.反应$\mathrm{SrSO_4(s)+CO_3^{2-}\rightleftharpoons SrCO_3(s)+SO_4^{2-}}$的平衡常数$K=\frac{K_{sp}(\mathrm{SrSO_4})}{K_{sp}(\mathrm{SrCO_3})}$
B.$a=-6.5$
C.曲线④代表含$\mathrm{SrCO_3(s)}$的$1.0\mathrm{mol· L^{-1}}\mathrm{NaCO_3}$溶液的变化曲线
D.对含$\mathrm{SrSO_4(s)}$且$\mathrm{Na_2SO_4}$和$\mathrm{Na_2CO_3}$初始浓度均为$1.0\mathrm{mol· L^{-1}}$的混合溶液,$\mathrm{pH\geq7.7}$时才发生沉淀转化
答案:
D
9.(2023·全国甲卷,15分)[化学——选修3:物质结构与性质]
将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
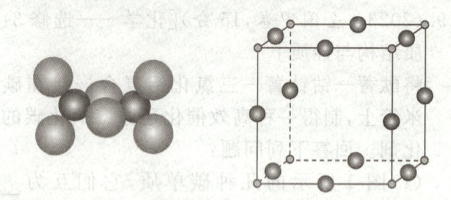
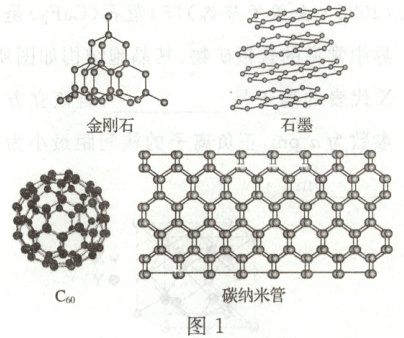
(1)图1所示的几种碳单质,它们互为
(2)酞菁和钴酞菁的分子结构如图2所示。
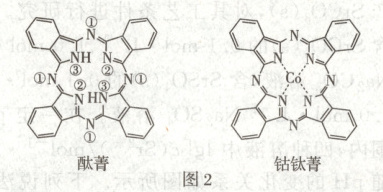
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的$\mathrm{N}$原子是
(3)气态$\mathrm{AlCl_3}$通常以二聚体$\mathrm{Al_2Cl_6}$的形式存在,其空间结构如图3a所示,二聚体中$\mathrm{Al}$的轨道杂化类型为
$\mathrm{AlF_3}$结构属立方晶系,晶胞如图3b所示,$\mathrm{F^-}$的配位数为
将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:
(1)图1所示的几种碳单质,它们互为
同素异形体
,其中属于原子晶体的是金刚石
,$\mathrm{C_{60}}$间的作用力是范德华力
。(2)酞菁和钴酞菁的分子结构如图2所示。

酞菁分子中所有原子共平面,其中p轨道能提供一对电子的$\mathrm{N}$原子是
③
(填图2酞菁中$\mathrm{N}$原子的标号)。钴酞菁分子中,钴离子的化合价为+2
,氮原子提供孤对电子与钴离子形成配位
键。(3)气态$\mathrm{AlCl_3}$通常以二聚体$\mathrm{Al_2Cl_6}$的形式存在,其空间结构如图3a所示,二聚体中$\mathrm{Al}$的轨道杂化类型为
$sp^{3}$
。$\mathrm{AlF_3}$的熔点为$1090°\mathrm{C}$,远高于$\mathrm{AlCl_3}$的$192°\mathrm{C}$,由此可以判断铝氟之间的化学键为离子
键。$\mathrm{AlF_3}$结构属立方晶系,晶胞如图3b所示,$\mathrm{F^-}$的配位数为
2
,若晶胞参数为$a\mathrm{pm}$,晶体密度$\rho=$$\frac{84}{N_{A}(a×10^{-10})^{3}}$
$\mathrm{g· cm^{-3}}$(列出计算式,阿伏加德罗常数的值为$N_\mathrm{A}$)。

答案:
解析
(1)图1所示物质为碳元素形成的不同单质,互为同素异形体。金刚石是碳原子间通过共价键形成的立体网状结构,为原子晶体;石墨属于混合型晶体,$C_{60}$为典型的分子晶体;碳纳米管是纳米级石墨晶体,$C_{60}$间的作用力是范德华力。
(2)酞菁分子中所有原子共平面,由酞菁的结构可知,酞菁分子中间有一个空腔,由8个碳原子和8个氮原子围成,这个空腔存在一个18电子的大π键,其中两个—NH—基团各提供两个p电子,其他的氮和碳各提供一个p电子,故p轨道能提供一对电子的N原子是③号N原子,钴酞菁分子中钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键。
(3)根据$AlCl_{3}$形成的二聚体结构,可知每个Al和4个Cl成键,杂化轨道类型为$sp^{3}$杂化。$AlF_{3}$的熔点远高于$AlCl_{3}$,则$AlF_{3}$为离子晶体,铝氟之间形成的是离子键。由$AlF_{3}$中的原子个数比,可知该晶胞中顶点为$Al^{3+}$,棱心为$F^{-}$,则与$F^{-}$距离最近的$Al^{3+}$有2个,即$F^{-}$的配位数为2。该晶胞中$Al^{3+}$数目为$8×\frac{1}{8}=1$,$F^{-}$数目为$12×\frac{1}{4}=3$,即1个晶胞中含1个$AlF_{3}$,根据晶胞的参数可知,晶体密度$\rho=\frac{84}{N_{A}(a×10^{-10})^{3}}g· cm^{-3}$。
答案
(1)同素异形体 金刚石 范德华力
(2)③ +2 配位
(3)$sp^{3}$ 离子 2 $\frac{84}{N_{A}(a×10^{-10})^{3}}$
(1)图1所示物质为碳元素形成的不同单质,互为同素异形体。金刚石是碳原子间通过共价键形成的立体网状结构,为原子晶体;石墨属于混合型晶体,$C_{60}$为典型的分子晶体;碳纳米管是纳米级石墨晶体,$C_{60}$间的作用力是范德华力。
(2)酞菁分子中所有原子共平面,由酞菁的结构可知,酞菁分子中间有一个空腔,由8个碳原子和8个氮原子围成,这个空腔存在一个18电子的大π键,其中两个—NH—基团各提供两个p电子,其他的氮和碳各提供一个p电子,故p轨道能提供一对电子的N原子是③号N原子,钴酞菁分子中钴离子的化合价为+2,氮原子提供孤对电子与钴离子形成配位键。
(3)根据$AlCl_{3}$形成的二聚体结构,可知每个Al和4个Cl成键,杂化轨道类型为$sp^{3}$杂化。$AlF_{3}$的熔点远高于$AlCl_{3}$,则$AlF_{3}$为离子晶体,铝氟之间形成的是离子键。由$AlF_{3}$中的原子个数比,可知该晶胞中顶点为$Al^{3+}$,棱心为$F^{-}$,则与$F^{-}$距离最近的$Al^{3+}$有2个,即$F^{-}$的配位数为2。该晶胞中$Al^{3+}$数目为$8×\frac{1}{8}=1$,$F^{-}$数目为$12×\frac{1}{4}=3$,即1个晶胞中含1个$AlF_{3}$,根据晶胞的参数可知,晶体密度$\rho=\frac{84}{N_{A}(a×10^{-10})^{3}}g· cm^{-3}$。
答案
(1)同素异形体 金刚石 范德华力
(2)③ +2 配位
(3)$sp^{3}$ 离子 2 $\frac{84}{N_{A}(a×10^{-10})^{3}}$
查看更多完整答案,请扫码查看


