2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年168优化重组卷五年高考真题分类汇编高中化学全一册通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第103页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
6. (2021·江苏卷)室温下,通过下列实验探究${NaHCO_{3}}$、${Na_{2}CO_{3}}$溶液的性质。
实验1:用$pH$试纸测量$0.1\ {mol· L^{-1}}{NaHCO_{3}}$溶液的$pH$,测得$pH$约为$8$
实验2:将$0.1\ {mol· L^{-1}}{NaHCO_{3}}$溶液与$0.1\ {mol· L^{-1}}{CaCl_{2}}$溶液等体积混合,产生白色沉淀
实验3:向$0.1\ {mol· L^{-1}}{Na_{2}CO_{3}}$溶液中通入${CO_{2}}$,溶液$pH$从$12$下降到约为$9$
实验4:向$0.1\ {mol· L^{-1}}{Na_{2}CO_{3}}$溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是(
A.由实验1可得出:$K_{ a2}{(H_{2}CO_{3})} > \dfrac{K_{ W}}{K_{ a1}{(H_{2}CO_{3})}}$
B.实验2中两溶液混合时有:$c{(Ca^{2+})}· c{(CO^{2-}_{3})} < K_{ sp}{(CaCO_{3})}$
C.实验3中发生反应的离子方程式为${CO^{2-}_{3} +H_{2}O +CO_{2} \xlongequal{} 2HCO^{-}_{3}}$
D.实验4中$c_{ 反应前}{(CO^{2-}_{3})} < c_{ 反应后}{(CO^{2-}_{3})}$
实验1:用$pH$试纸测量$0.1\ {mol· L^{-1}}{NaHCO_{3}}$溶液的$pH$,测得$pH$约为$8$
实验2:将$0.1\ {mol· L^{-1}}{NaHCO_{3}}$溶液与$0.1\ {mol· L^{-1}}{CaCl_{2}}$溶液等体积混合,产生白色沉淀
实验3:向$0.1\ {mol· L^{-1}}{Na_{2}CO_{3}}$溶液中通入${CO_{2}}$,溶液$pH$从$12$下降到约为$9$
实验4:向$0.1\ {mol· L^{-1}}{Na_{2}CO_{3}}$溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是(
C
)A.由实验1可得出:$K_{ a2}{(H_{2}CO_{3})} > \dfrac{K_{ W}}{K_{ a1}{(H_{2}CO_{3})}}$
B.实验2中两溶液混合时有:$c{(Ca^{2+})}· c{(CO^{2-}_{3})} < K_{ sp}{(CaCO_{3})}$
C.实验3中发生反应的离子方程式为${CO^{2-}_{3} +H_{2}O +CO_{2} \xlongequal{} 2HCO^{-}_{3}}$
D.实验4中$c_{ 反应前}{(CO^{2-}_{3})} < c_{ 反应后}{(CO^{2-}_{3})}$
答案:
6.C
7. (2021·浙江1月,2分)$25\ {^{\circ}C}$时,下列说法正确的是(
A.$NaHA$溶液呈酸性,可以推测${H_{2}A}$为强酸
B.可溶性正盐$BA$溶液呈中性,可以推测$BA$为强酸强碱盐
C.$0.010\ {mol· L^{-1}}$、$0.10\ {mol· L^{-1}}$的醋酸溶液的电离度分别为$a_{1}$、$a_{2}$,则$a_{1} < a_{2}$
D.$100\ {mL}\ pH=10.00$的${Na_{2}CO_{3}}$溶液中水电离出的${H^{+}}$的物质的量为$1.0× 10^{-5}\ {mol}$
D
)A.$NaHA$溶液呈酸性,可以推测${H_{2}A}$为强酸
B.可溶性正盐$BA$溶液呈中性,可以推测$BA$为强酸强碱盐
C.$0.010\ {mol· L^{-1}}$、$0.10\ {mol· L^{-1}}$的醋酸溶液的电离度分别为$a_{1}$、$a_{2}$,则$a_{1} < a_{2}$
D.$100\ {mL}\ pH=10.00$的${Na_{2}CO_{3}}$溶液中水电离出的${H^{+}}$的物质的量为$1.0× 10^{-5}\ {mol}$
答案:
7.D
8. (2021·河北)$BiOCl$是一种具有珍珠光泽的材料,利用金属$Bi$制备$BiOCl$的工艺流程如图:
下列说法错误的是(
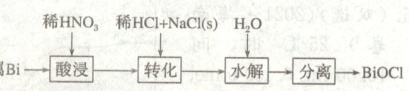
A.酸浸工序中分次加入稀${HNO_{3}}$可降低反应剧烈程度
B.转化工序中加入稀$HCl$可抑制生成${BiONO_{3}}$
C.水解工序中加入少量${CH_{3}COONa(s)}$可提高${Bi^{3+}}$水解程度
D.水解工序中加入少量${NH_{4}NO_{3}(s)}$有利于$BiOCl$的生成
下列说法错误的是(
D
)
A.酸浸工序中分次加入稀${HNO_{3}}$可降低反应剧烈程度
B.转化工序中加入稀$HCl$可抑制生成${BiONO_{3}}$
C.水解工序中加入少量${CH_{3}COONa(s)}$可提高${Bi^{3+}}$水解程度
D.水解工序中加入少量${NH_{4}NO_{3}(s)}$有利于$BiOCl$的生成
答案:
8.D
9. (双选)(2021·山东卷)赖氨酸${[H_{3}N^{+}(CH_{2})_{4}CH(NH_{2})COO^{-}]}$,用$HR$表示]是人体必需氨基酸,其盐酸盐${(H_{3}RCl_{2})}$在水溶液中存在如下平衡:${H_{3}R^{2+}\xrightleftharpoons{K_{1}}H_{2}R^{+}\xrightleftharpoons{K_{2}}HR\xrightleftharpoons{K_{3}}R^{-}}$。向一定浓度的${H_{3}RCl_{2}}$溶液中滴加$NaOH$溶液,溶液中${H_{3}R^{2+}}$、${H_{2}R^{+}}$、$HR$和${R^{-}}$的分布系数$\delta( X)$随$pH$变化如图所示。已知$\delta( X)=\dfrac{c( X)}{c{(H_{3}R^{2+})} +c{(H_{2}R^{+})} +c(HR) +c{(R^{-})}}$,下列表述正确的是(

A.$\dfrac{K_{2}}{K_{1}} > \dfrac{K_{3}}{K_{2}}$
B.$ M$点,$c{(Cl^{-})} +c{(OH^{-})} +c{(R^{-})}=2c{(H_{2}R^{+})} +c{(Na^{+})} +c{(H^{+})}$
C.$ O$点,$pH=\dfrac{- \lg \nolimits K_{2}- \lg \nolimits K_{3}}{2}$
D.$ P$点,$c{(Na^{+})} > c{(Cl^{-})} > c{(OH^{-})} > c{(H^{+})}$
CD
)
A.$\dfrac{K_{2}}{K_{1}} > \dfrac{K_{3}}{K_{2}}$
B.$ M$点,$c{(Cl^{-})} +c{(OH^{-})} +c{(R^{-})}=2c{(H_{2}R^{+})} +c{(Na^{+})} +c{(H^{+})}$
C.$ O$点,$pH=\dfrac{- \lg \nolimits K_{2}- \lg \nolimits K_{3}}{2}$
D.$ P$点,$c{(Na^{+})} > c{(Cl^{-})} > c{(OH^{-})} > c{(H^{+})}$
答案:
9.CD
10. (2021·北京卷)下列实验中,均产生白色沉淀。

下列分析不正确的是(
A.${Na_{2}CO_{3}}$与${NaHCO_{3}}$溶液中所含微粒种类相同
B.${CaCl_{2}}$能促进${Na_{2}CO_{3}}$、${NaHCO_{3}}$水解
C.${Al_{2}(SO_{4})_{3}}$能促进${Na_{2}CO_{3}}$、${NaHCO_{3}}$水解
D.$4$个实验中,溶液滴入后,试管中溶液$pH$均降低

下列分析不正确的是(
B
)A.${Na_{2}CO_{3}}$与${NaHCO_{3}}$溶液中所含微粒种类相同
B.${CaCl_{2}}$能促进${Na_{2}CO_{3}}$、${NaHCO_{3}}$水解
C.${Al_{2}(SO_{4})_{3}}$能促进${Na_{2}CO_{3}}$、${NaHCO_{3}}$水解
D.$4$个实验中,溶液滴入后,试管中溶液$pH$均降低
答案:
10.B
11. (2023·山东卷,12分)盐湖卤水(主要含${Na^{+}}$、${Mg^{2+}}$、${Li^{+}}$、${Cl^{-}}$、${SO^{2-}_{4}}$和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备${Li_{2}CO_{3}}$的工艺流程如下:

已知:常温下,$K_{ sp}{(Li_{2}CO_{3})}=2.2× 10^{-2}$。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的${B(OH)_{3}}$在水中存在平衡:${B(OH)_{3} +H_{2}O <=>[][] H^{+} +[B(OH)_{4}]^{-}}$(常温下,$K_{ a}=10^{-9.24}$);${B(OH)_{3}}$与$NaOH$溶液反应可制备硼砂${Na_{2}B_{4}O_{5}(OH)_{4}· 8H_{2}O}$。常温下,在$0.10\ {mol· L^{-1}}$硼砂溶液中,${[B_{4}O_{5}(OH)_{4}]^{2-}}$水解生成等物质的量浓度的${B(OH)_{3}}$和${[B(OH)_{4}]^{-}}$,该水解反应的离子方程式为,该溶液$pH=$。
(2)滤渣I的主要成分是(填化学式);精制I后溶液中${Li^{+}}$的浓度为$2.0\ {mol· L^{-1}}$,则常温下精制II过程中${CO^{2-}_{3}}$浓度应控制在${mol· L^{-1}}$以下。若脱硼后直接进行精制I,除无法回收$HCl$外,还将增加的用量(填化学式)。
(3)精制II的目的是;进行操作$X$时应选择的试剂是,若不进行该操作而直接浓缩,将导致。

已知:常温下,$K_{ sp}{(Li_{2}CO_{3})}=2.2× 10^{-2}$。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的${B(OH)_{3}}$在水中存在平衡:${B(OH)_{3} +H_{2}O <=>[][] H^{+} +[B(OH)_{4}]^{-}}$(常温下,$K_{ a}=10^{-9.24}$);${B(OH)_{3}}$与$NaOH$溶液反应可制备硼砂${Na_{2}B_{4}O_{5}(OH)_{4}· 8H_{2}O}$。常温下,在$0.10\ {mol· L^{-1}}$硼砂溶液中,${[B_{4}O_{5}(OH)_{4}]^{2-}}$水解生成等物质的量浓度的${B(OH)_{3}}$和${[B(OH)_{4}]^{-}}$,该水解反应的离子方程式为,该溶液$pH=$。
(2)滤渣I的主要成分是(填化学式);精制I后溶液中${Li^{+}}$的浓度为$2.0\ {mol· L^{-1}}$,则常温下精制II过程中${CO^{2-}_{3}}$浓度应控制在${mol· L^{-1}}$以下。若脱硼后直接进行精制I,除无法回收$HCl$外,还将增加的用量(填化学式)。
(3)精制II的目的是;进行操作$X$时应选择的试剂是,若不进行该操作而直接浓缩,将导致。
答案:
11.解析
(1)[B₄O₅(OH)₄]²⁻水解生成等物质的量浓度的B(OH)₃和[B(OH)₄]⁻,则根据原子守恒和电荷守恒可配平其水解反应的方程式为[B₄O₅(OH)₄]²⁻+5H₂O⇌2B(OH)₃+2[B(OH)₄]⁻。该溶液中c[B(OH)₃]=c{[B(OH)₄]⁻},根据B(OH)₃在水中存在的平衡B(OH)₃+H₂O⇌H⁺+[B(OH)₄]⁻的平衡常数Kₐ=$\frac{c(H^+)·c([B(OH)_4]^-)}{c[B(OH)_3]}$ =10⁻⁹.²⁴知,c[B(OH)₃]=c{[B(OH)₄]⁻}时,c(H⁺)=10⁻⁹.²⁴mol·L⁻¹,pH=−lg10⁻⁹.²⁴ =9.24。
(2)加入生石灰是为了除去水浸后滤液中残留的Mg²⁺、SO₄²⁻,则滤渣Ⅰ的主要成分为Mg(OH)₂、CaSO₄;精制Ⅱ加入纯碱的目的是沉淀Ca²⁺而不沉淀Li⁺,根据Kₛₚ(Li₂CO₃)=2.2×10⁻²,精制Ⅰ后溶液中c(Li⁺)=2.0mol·L⁻¹,知应控制c(CO₃²⁻)<$\frac{K_{sp}(Li_2CO_3)}{c^2(Li^+)}$ =$\frac{2.2×10^{-2}}{2.0^2}$mol·L⁻¹=0.0055mol·L⁻¹。若脱硼后直接进行精制Ⅰ,除无法回收HCl(可与CaO反应)外,还会增加生石灰的用量。
(3)精制Ⅰ加入的生石灰过量,精制Ⅱ加入纯碱(过量)的目的是除去溶液中Ca²⁺,操作X是为了除去过量的碳酸钠,结合“浓缩”时得到NaCl可知,加入的试剂为盐酸,若不进行该操作而直接浓缩,由于Na₂CO₃水解使溶液呈碱性,则会有LiOH析出。
答案
(1)[B₄O₅(OH)₄]²⁻+5H₂O⇌2B(OH)₃+2[B(OH)₄]⁻ 9.24
(2)Mg(OH)₂、CaSO₄ 0.0055 CaO
(3)除去溶液中Ca²⁺ 盐酸 有LiOH析出
(1)[B₄O₅(OH)₄]²⁻水解生成等物质的量浓度的B(OH)₃和[B(OH)₄]⁻,则根据原子守恒和电荷守恒可配平其水解反应的方程式为[B₄O₅(OH)₄]²⁻+5H₂O⇌2B(OH)₃+2[B(OH)₄]⁻。该溶液中c[B(OH)₃]=c{[B(OH)₄]⁻},根据B(OH)₃在水中存在的平衡B(OH)₃+H₂O⇌H⁺+[B(OH)₄]⁻的平衡常数Kₐ=$\frac{c(H^+)·c([B(OH)_4]^-)}{c[B(OH)_3]}$ =10⁻⁹.²⁴知,c[B(OH)₃]=c{[B(OH)₄]⁻}时,c(H⁺)=10⁻⁹.²⁴mol·L⁻¹,pH=−lg10⁻⁹.²⁴ =9.24。
(2)加入生石灰是为了除去水浸后滤液中残留的Mg²⁺、SO₄²⁻,则滤渣Ⅰ的主要成分为Mg(OH)₂、CaSO₄;精制Ⅱ加入纯碱的目的是沉淀Ca²⁺而不沉淀Li⁺,根据Kₛₚ(Li₂CO₃)=2.2×10⁻²,精制Ⅰ后溶液中c(Li⁺)=2.0mol·L⁻¹,知应控制c(CO₃²⁻)<$\frac{K_{sp}(Li_2CO_3)}{c^2(Li^+)}$ =$\frac{2.2×10^{-2}}{2.0^2}$mol·L⁻¹=0.0055mol·L⁻¹。若脱硼后直接进行精制Ⅰ,除无法回收HCl(可与CaO反应)外,还会增加生石灰的用量。
(3)精制Ⅰ加入的生石灰过量,精制Ⅱ加入纯碱(过量)的目的是除去溶液中Ca²⁺,操作X是为了除去过量的碳酸钠,结合“浓缩”时得到NaCl可知,加入的试剂为盐酸,若不进行该操作而直接浓缩,由于Na₂CO₃水解使溶液呈碱性,则会有LiOH析出。
答案
(1)[B₄O₅(OH)₄]²⁻+5H₂O⇌2B(OH)₃+2[B(OH)₄]⁻ 9.24
(2)Mg(OH)₂、CaSO₄ 0.0055 CaO
(3)除去溶液中Ca²⁺ 盐酸 有LiOH析出
查看更多完整答案,请扫码查看


