第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
一、酸碱反应的简单计算
【例 1】盐酸是一种重要的化工原料,但在使用前一般需测定其中 HCl 的质量分数。现取 200 g 未知溶质质量分数的盐酸溶液于锥形瓶中,然后向锥形瓶中滴加溶质质量分数为 20%的氢氧化钠溶液,pH=7(常温)时消耗氢氧化钠溶液 200 g,求盐酸中 HCl 的质量分数。
【例 1】盐酸是一种重要的化工原料,但在使用前一般需测定其中 HCl 的质量分数。现取 200 g 未知溶质质量分数的盐酸溶液于锥形瓶中,然后向锥形瓶中滴加溶质质量分数为 20%的氢氧化钠溶液,pH=7(常温)时消耗氢氧化钠溶液 200 g,求盐酸中 HCl 的质量分数。
答案:
解:设盐酸溶液中HCl的质量分数为$x$。
$\mathrm{HCl} + \mathrm{NaOH} \longrightarrow \mathrm{NaCl} + \mathrm{H_2O}$
$36.5$ $40$
$200\mathrm{g} \cdot x$ $200\mathrm{g} × 20\%$
$\frac{36.5}{40} = \frac{200\mathrm{g} \cdot x}{200\mathrm{g} × 20\%}$ $x = 18.25\%$
答:盐酸中HCl的质量分数为$18.25\%$。
$\mathrm{HCl} + \mathrm{NaOH} \longrightarrow \mathrm{NaCl} + \mathrm{H_2O}$
$36.5$ $40$
$200\mathrm{g} \cdot x$ $200\mathrm{g} × 20\%$
$\frac{36.5}{40} = \frac{200\mathrm{g} \cdot x}{200\mathrm{g} × 20\%}$ $x = 18.25\%$
答:盐酸中HCl的质量分数为$18.25\%$。
【例 2】某环保小组监测到一工厂向河水中排放的酸性废液中含有 CuSO₄。
(1)实验室实验时,我们观察到的 CuSO₄溶液的颜色为
(2)为了测定废液中 CuSO₄的质量分数,该小组取了 50 g 废液,逐滴加入 NaOH 溶液至过量。测得生成的 Cu(OH)₂沉淀(无其他沉淀)的质量与所加 NaOH 溶液的质量关系如图所示。
①图中的 OA 段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB 段表示氢氧化钠溶液与 CuSO₄发生反应,反应结束后生成的沉淀质量是
②计算 50 g 废液中 CuSO₄的质量。(写出计算过程)
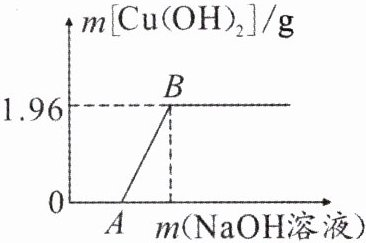
(1)实验室实验时,我们观察到的 CuSO₄溶液的颜色为
蓝色
。(2)为了测定废液中 CuSO₄的质量分数,该小组取了 50 g 废液,逐滴加入 NaOH 溶液至过量。测得生成的 Cu(OH)₂沉淀(无其他沉淀)的质量与所加 NaOH 溶液的质量关系如图所示。
①图中的 OA 段表示氢氧化钠溶液与废液中的酸性物质发生反应,没有沉淀产生。AB 段表示氢氧化钠溶液与 CuSO₄发生反应,反应结束后生成的沉淀质量是
1.96
g。②计算 50 g 废液中 CuSO₄的质量。(写出计算过程)
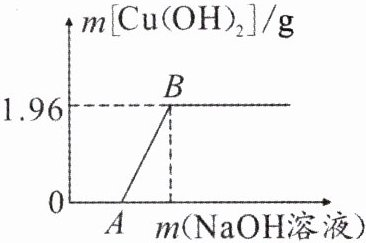
答案:
(1)蓝色
(2)①1.96
②解:设废液中$\mathrm{CuSO_4}$的质量为$x$。
$\mathrm{CuSO_4} + 2\mathrm{NaOH} \longrightarrow \mathrm{Cu(OH)_2} \downarrow + \mathrm{Na_2SO_4}$
$160$ $98$
$x$ $1.96\mathrm{g}$
$\frac{160}{98} = \frac{x}{1.96\mathrm{g}}$ $x = 3.2\mathrm{g}$
答:$50\mathrm{g}$废液中$\mathrm{CuSO_4}$的质量是$3.2\mathrm{g}$。
(1)蓝色
(2)①1.96
②解:设废液中$\mathrm{CuSO_4}$的质量为$x$。
$\mathrm{CuSO_4} + 2\mathrm{NaOH} \longrightarrow \mathrm{Cu(OH)_2} \downarrow + \mathrm{Na_2SO_4}$
$160$ $98$
$x$ $1.96\mathrm{g}$
$\frac{160}{98} = \frac{x}{1.96\mathrm{g}}$ $x = 3.2\mathrm{g}$
答:$50\mathrm{g}$废液中$\mathrm{CuSO_4}$的质量是$3.2\mathrm{g}$。
练习 1
做实验时,小科取了 40 mL 的 Ba(OH)₂溶液,并随手倒入等量的稀盐酸(均未知浓度),老师发现后,递给他一瓶未知质量分数的 K₂CO₃溶液,让小科来检测混合溶液的酸碱性。小科在混合溶液中慢慢滴入 K₂CO₃溶液,获得相关数据并将其绘成如图所示图像。
(1)刚加入 K₂CO₃溶液时,发现没有沉淀生成,却有气泡产生,则原混合溶液呈
(2)计算 K₂CO₃溶液的溶质质量分数。
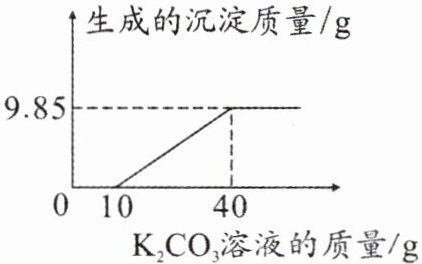
做实验时,小科取了 40 mL 的 Ba(OH)₂溶液,并随手倒入等量的稀盐酸(均未知浓度),老师发现后,递给他一瓶未知质量分数的 K₂CO₃溶液,让小科来检测混合溶液的酸碱性。小科在混合溶液中慢慢滴入 K₂CO₃溶液,获得相关数据并将其绘成如图所示图像。
(1)刚加入 K₂CO₃溶液时,发现没有沉淀生成,却有气泡产生,则原混合溶液呈
酸性
(填“酸性”“碱性”或“中性”),其中所含的溶质有$\mathrm{BaCl_2}$、$\mathrm{HCl}$
(用化学式表示)。(2)计算 K₂CO₃溶液的溶质质量分数。

答案:
(1)酸性 $\mathrm{BaCl_2}$、$\mathrm{HCl}$
(2)解:由图可知,$(40\mathrm{g} - 10\mathrm{g})\mathrm{K_2CO_3}$溶液与氯化钡溶液全部反应,生成$9.85\mathrm{g}$碳酸钡沉淀,设$30\mathrm{g}\mathrm{K_2CO_3}$溶液中溶质的质量为$x$。
$\mathrm{K_2CO_3} + \mathrm{BaCl_2} \longrightarrow \mathrm{BaCO_3} \downarrow + 2\mathrm{KCl}$
$138$ $197$
$x$ $9.85\mathrm{g}$
$\frac{138}{197} = \frac{x}{9.85\mathrm{g}}$ $x = 6.9\mathrm{g}$
该$\mathrm{K_2CO_3}$溶液中溶质的质量分数为$\frac{6.9\mathrm{g}}{40\mathrm{g} - 10\mathrm{g}} × 100\% = 23\%$
答:$\mathrm{K_2CO_3}$溶液中溶质的质量分数为$23\%$。
(1)酸性 $\mathrm{BaCl_2}$、$\mathrm{HCl}$
(2)解:由图可知,$(40\mathrm{g} - 10\mathrm{g})\mathrm{K_2CO_3}$溶液与氯化钡溶液全部反应,生成$9.85\mathrm{g}$碳酸钡沉淀,设$30\mathrm{g}\mathrm{K_2CO_3}$溶液中溶质的质量为$x$。
$\mathrm{K_2CO_3} + \mathrm{BaCl_2} \longrightarrow \mathrm{BaCO_3} \downarrow + 2\mathrm{KCl}$
$138$ $197$
$x$ $9.85\mathrm{g}$
$\frac{138}{197} = \frac{x}{9.85\mathrm{g}}$ $x = 6.9\mathrm{g}$
该$\mathrm{K_2CO_3}$溶液中溶质的质量分数为$\frac{6.9\mathrm{g}}{40\mathrm{g} - 10\mathrm{g}} × 100\% = 23\%$
答:$\mathrm{K_2CO_3}$溶液中溶质的质量分数为$23\%$。
查看更多完整答案,请扫码查看


