第76页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
6. 某化肥厂生产的一种化肥包装袋上的部分说明如图,化学兴趣小组的同学们为测定其纯度,取样品5.6 g,完全溶于水,向所得溶液中加入100 g一定浓度的硝酸银溶液,恰好完全反应生成14.35 g沉淀(${NH_{4}Cl +AgNO_{3}\xlongequal{}NH_{4}NO_{3} +AgCl\downarrow}$)。通过计算判断该化肥是否合格。
答案:
设样品中氯化铵的质量为x。
NH₄Cl + AgNO₃ = NH₄NO₃ + AgCl↓
53.5g 143.5g
x 14.35g
$\frac{53.5}{143.5}=\frac{x}{14.35g}$
x=5.35g
化肥中氯化铵的质量分数=$\frac{5.35g}{5.6g}× 100\%\approx 95.5\%$
因为$95\%<95.5\%<98\%$,所以该化肥合格。
NH₄Cl + AgNO₃ = NH₄NO₃ + AgCl↓
53.5g 143.5g
x 14.35g
$\frac{53.5}{143.5}=\frac{x}{14.35g}$
x=5.35g
化肥中氯化铵的质量分数=$\frac{5.35g}{5.6g}× 100\%\approx 95.5\%$
因为$95\%<95.5\%<98\%$,所以该化肥合格。
7. 长久使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,用稀盐酸可以清除水垢。发生反应的化学方程式为${CaCO_{3} +2HCl\xlongequal{}CaCl_{2} +H_{2}O +CO_{2}\uparrow}$。某学校化学课外兴趣小组的同学通过实验测定水垢中碳酸钙的含量,将足量的稀盐酸加入200 g水垢中,同时测量3 min内产生气体的质量,结果如下表:
|时间/s|0|30|50|90|120|150|180|
|质量/g|0|30|50|60|80|66|66|
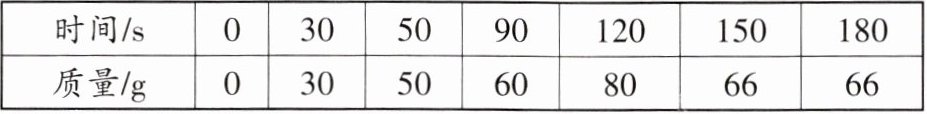
计算200 g水垢中所含的碳酸钙的质量分数。(写出计算过程)
|时间/s|0|30|50|90|120|150|180|
|质量/g|0|30|50|60|80|66|66|

计算200 g水垢中所含的碳酸钙的质量分数。(写出计算过程)
答案:
解:由表可知,当时间达到150 s后,产生气体的质量不再增加,说明反应已经完全,此时产生二氧化碳的质量为66 g。
设200 g水垢中所含碳酸钙的质量为x。
$\begin{aligned}&CaCO_{3}&+&2HCl&=&CaCl_{2}&+&H_{2}O&+&CO_{2}\uparrow \\&100&&&&&&&&44\\&x&&&&&&&&66g\end{aligned}$
$\frac{100}{44}=\frac{x}{66g}$
$x = 150g$
则200 g水垢中所含的碳酸钙的质量分数为:$\frac{150g}{200g}×100\% = 75\%$
答:200 g水垢中所含的碳酸钙的质量分数为75%。
设200 g水垢中所含碳酸钙的质量为x。
$\begin{aligned}&CaCO_{3}&+&2HCl&=&CaCl_{2}&+&H_{2}O&+&CO_{2}\uparrow \\&100&&&&&&&&44\\&x&&&&&&&&66g\end{aligned}$
$\frac{100}{44}=\frac{x}{66g}$
$x = 150g$
则200 g水垢中所含的碳酸钙的质量分数为:$\frac{150g}{200g}×100\% = 75\%$
答:200 g水垢中所含的碳酸钙的质量分数为75%。
8. 工业上可以通过如图工艺流程处理工厂排放的含二氧化硫的尾气,并获得硫酸和氢气。

(1)写出主反应器中发生反应的化学方程式:______。
(2)尾气中${SO_{2}}$的质量分数为10%,若吸收该尾气80 t,理论上能产生氢气的质量为多少?

(1)写出主反应器中发生反应的化学方程式:______。
(2)尾气中${SO_{2}}$的质量分数为10%,若吸收该尾气80 t,理论上能产生氢气的质量为多少?
答案:
(1)$SO_{2}+2H_{2}O+I_{2}=H_{2}SO_{4}+2HI$
(2)
设理论上能产生氢气的质量为$x$。
由工艺流程可知,主反应器中反应为$SO_{2}+2H_{2}O + I_{2}=H_{2}SO_{4}+2HI$,膜反应器中反应为$2HI\xlongequal{一定条件}H_{2}\uparrow+I_{2}$,总反应方程式为$SO_{2}+2H_{2}O=H_{2}SO_{4}+H_{2}\uparrow$。
$80t$尾气中$SO_{2}$的质量为$80t×10\% = 8t$
$SO_{2}+2H_{2}O=H_{2}SO_{4}+H_{2}\uparrow$
$64$ $2$
$8t$ $x$
$\frac{64}{2}=\frac{8t}{x}$
$x = 0.25t$
答:理论上能产生氢气的质量为$0.25t$。
(1)$SO_{2}+2H_{2}O+I_{2}=H_{2}SO_{4}+2HI$
(2)
设理论上能产生氢气的质量为$x$。
由工艺流程可知,主反应器中反应为$SO_{2}+2H_{2}O + I_{2}=H_{2}SO_{4}+2HI$,膜反应器中反应为$2HI\xlongequal{一定条件}H_{2}\uparrow+I_{2}$,总反应方程式为$SO_{2}+2H_{2}O=H_{2}SO_{4}+H_{2}\uparrow$。
$80t$尾气中$SO_{2}$的质量为$80t×10\% = 8t$
$SO_{2}+2H_{2}O=H_{2}SO_{4}+H_{2}\uparrow$
$64$ $2$
$8t$ $x$
$\frac{64}{2}=\frac{8t}{x}$
$x = 0.25t$
答:理论上能产生氢气的质量为$0.25t$。
查看更多完整答案,请扫码查看


