2025年暑假生活北京师范大学出版社高一化学人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假生活北京师范大学出版社高一化学人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
3. 众所周知,一氧化氮是一种大气污染物,但是这种气体小分子在生物体内却是一种重要的“信使分子”,具有保护心血管以及提升记忆力的作用。下列关于NO的说法正确的是(
A.NO是无色气体,易溶于水,是酸性氧化物
B.NO在人体内可作“信使分子”,因此大气中的NO对人体无害
C.NO在空气中可以转化为$NO_{2}$,二者都是大气污染物
D.NO在化学反应中,只能作还原剂,不能作氧化剂
C
)。A.NO是无色气体,易溶于水,是酸性氧化物
B.NO在人体内可作“信使分子”,因此大气中的NO对人体无害
C.NO在空气中可以转化为$NO_{2}$,二者都是大气污染物
D.NO在化学反应中,只能作还原剂,不能作氧化剂
答案:
C 解析:$ NO $ 是无色气体,不溶于水,不能和碱反应生成盐和水,故不是酸性氧化物,A 项错误;微量 $ NO $ 对人体有益,但大气中的 $ NO $ 有毒,对人的呼吸系统有害,B 项错误;$ NO $ 在空气中可以转化为 $ NO_{2} $,二者都是大气污染物,C 项正确;$ NO $ 中氮元素的化合价为 +2,处于中间价态,在化学反应中,$ NO $ 既能作还原剂又能作氧化剂,D 项错误。
4. 将$V\ mL$NO和$NO_{2}$的混合气体通过水吸收后,得到无色气体A。将此无色气体A与等体积的$O_{2}$通入水中充分吸收后,得到5mL无色气体B。下列说法不正确的是(
A.气体A是NO,气体B是$O_{2}$
B.气体A的体积是20mL
C.V的取值范围是$20 < V < 60$
D.将盛有体积比为4:1的$NO_{2}和O_{2}$的混合气体的试管倒立于水槽中充分反应后,试管中所得溶液的物质的量浓度为$\frac{1}{22.4}mol/L$
D
)。A.气体A是NO,气体B是$O_{2}$
B.气体A的体积是20mL
C.V的取值范围是$20 < V < 60$
D.将盛有体积比为4:1的$NO_{2}和O_{2}$的混合气体的试管倒立于水槽中充分反应后,试管中所得溶液的物质的量浓度为$\frac{1}{22.4}mol/L$
答案:
D 解析:因为 $ NO $ 不与水反应,$ NO_{2} $ 能与水发生反应 $ 3NO_{2} + H_{2}O = 2HNO_{3} + NO $,故无色气体 A 为 $ NO $;将 $ NO $ 与 $ O_{2} $ 同时通入水中发生反应 $ 4NO + 3O_{2} + 2H_{2}O = 4HNO_{3} $,由 $ NO $ 与 $ O_{2} $ 等体积可知 $ O_{2} $ 过量,则无色气体 B 为 $ O_{2} $,A 项正确。由 A 项分析可知,过量的氧气的体积为 5 mL,而开始反应时 $ NO $ 与 $ O_{2} $ 的体积相等,根据反应 $ 4NO + 3O_{2} + 2H_{2}O = 4HNO_{3} $ 可知,剩余 $ O_{2} $ 的体积占通入 $ O_{2} $ 总体积的 $ \frac{1}{4} $,因此可知 $ NO $(气体 A)的体积为 $ \frac{5 mL}{\frac{1}{4}} = 20 mL $,B 项正确。由 B 项分析可知,$ NO_{2} $ 与水反应产生的 $ NO $ 和原来的 $ NO $ 共 20 mL,若 $ NO $ 全部来源于原气体,则 $ V = 20 $;若 $ NO $ 全部是由 $ NO_{2} $ 与水反应产生的,根据反应 $ 3NO_{2} + H_{2}O = 2HNO_{3} + NO $ 可知 $ V = 3×20 = 60 $。因此,$ V $ 的取值范围是 $ 20 < V < 60 $,C 项正确。将盛有体积比为 4 : 1 的 $ NO_{2} $ 和 $ O_{2} $ 的混合气体的试管倒立于水槽中充分反应,发生反应的化学方程式为 $ 4NO_{2} + O_{2} + 2H_{2}O = 4HNO_{3} $,恰好完全转化为硝酸,但由于未指明气体所处的外界条件,因此不能确定气体摩尔体积,就不能计算气体的物质的量及所得酸溶液的浓度,D 项错误。
5. 将湿润的红色石蕊试纸放在下列实验的试管口,试纸不会变成蓝色的是(
A.加热浓氨水
B.加热$NH_{4}Cl和NaOH$的混合溶液
C.加热$NH_{4}Cl和Ca(OH)_{2}$的固体混合物
D.加热$NH_{4}Cl$固体
D
)。A.加热浓氨水
B.加热$NH_{4}Cl和NaOH$的混合溶液
C.加热$NH_{4}Cl和Ca(OH)_{2}$的固体混合物
D.加热$NH_{4}Cl$固体
答案:
D 解析:加热浓氨水会挥发出 $ NH_{3} $,湿润的红色石蕊试纸遇 $ NH_{3} $ 变蓝,A 项不符合题意;加热 $ NH_{4}Cl $ 和 $ NaOH $ 的混合溶液,有 $ NH_{3} $ 放出,湿润的红色石蕊试纸遇 $ NH_{3} $ 变蓝,B 项不符合题意;加热 $ NH_{4}Cl $ 和 $ Ca(OH)_{2} $ 的固体混合物会放出 $ NH_{3} $,湿润的红色石蕊试纸遇 $ NH_{3} $ 变蓝,C 项不符合题意;加热 $ NH_{4}Cl $ 固体会生成 $ NH_{3} $ 和氯化氢,$ NH_{3} $ 和氯化氢遇冷又在试管口附近生成氯化铵,没有 $ NH_{3} $ 放出,湿润的红色石蕊试纸不变蓝,D 项符合题意。
6. 下列实验室制取$NH_{3}$的装置和选用的试剂正确的是(

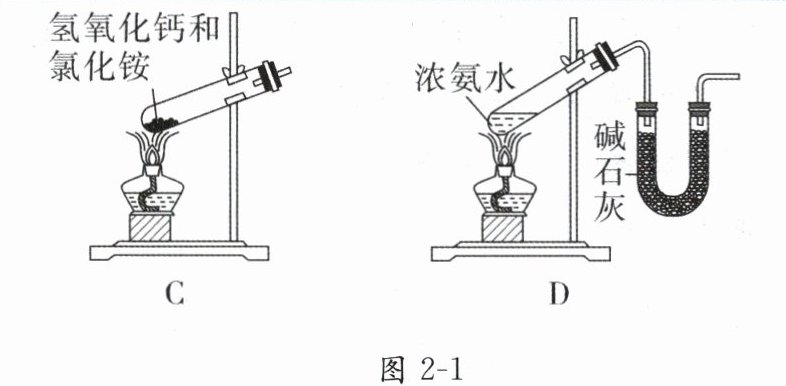
D
)。

答案:
D 解析:氯化铵受热分解为 $ NH_{3} $ 和氯化氢,二者在试管口遇冷又重新结合成氯化铵,得不到 $ NH_{3} $,A 项错误;$ NH_{3} $ 能被浓硫酸吸收,应用碱石灰干燥 $ NH_{3} $,B 项错误;加热固体制备气体时,试管口应略向下倾斜,以防止产生的水蒸气冷凝倒流,使试管炸裂,C 项错误;浓氨水易挥发,加热能够促进 $ NH_{3} $ 逸出,可以用来制备 $ NH_{3} $,并且可用碱石灰干燥 $ NH_{3} $,D 项正确。
7. 下列说法正确的是(
A.在稀硫酸中加入铜粉,铜粉不溶解,说明铜不和任何酸反应
B.大量的二氧化硫和二氧化氮排放到空气中能形成酸雨
C.锌与稀硝酸反应可以得到氢气
D.检验久置在空气中的$Na_{2}SO_{3}$溶液是否变质,可取少量溶液于试管中,先加入稀$HNO_{3}$溶液,再加入$BaCl_{2}$溶液来检验
B
)。A.在稀硫酸中加入铜粉,铜粉不溶解,说明铜不和任何酸反应
B.大量的二氧化硫和二氧化氮排放到空气中能形成酸雨
C.锌与稀硝酸反应可以得到氢气
D.检验久置在空气中的$Na_{2}SO_{3}$溶液是否变质,可取少量溶液于试管中,先加入稀$HNO_{3}$溶液,再加入$BaCl_{2}$溶液来检验
答案:
B 解析:铜虽然不和稀硫酸反应,但铜可以和稀硝酸反应,也能在加热条件下与浓硫酸发生反应,A 项错误;大量的二氧化硫、二氧化氮排放到大气中,能溶于雨水形成酸雨,B 项正确;稀硝酸具有强氧化性,与金属锌反应生成一氧化氮,不能生成氢气,C 项错误;取少量久置在空气中的亚硫酸钠溶液于试管中,加入稀 $ HNO_{3} $ 溶液,即使亚硫酸钠溶液没有变质,也会被硝酸氧化成硫酸钠,因此不能加入稀 $ HNO_{3} $ 溶液,应该加入稀盐酸,D 项错误。
8. 下列关于硝酸的说法正确的是(
A.稀硝酸能与铁发生反应,但浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D.浓硝酸与Cu反应不可能生成NO
B
)。A.稀硝酸能与铁发生反应,但浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D.浓硝酸与Cu反应不可能生成NO
答案:
B 解析:稀硝酸、浓硝酸都能与铁发生氧化还原反应,A 项错误;稀硝酸、浓硝酸都具有很强的氧化性,都是强氧化剂,B 项正确;硝酸在水溶液里完全电离,所以浓硝酸、稀硝酸都是强酸,C 项错误;浓硝酸与铜反应,若铜过量,随着反应的进行,硝酸的浓度减小,则会生成 $ NO $,D 项错误。
(1)探究$NH_{3}$的溶解性。标准状况下,装置D中收集满$NH_{3}$后,关闭弹簧夹$K_{1}$、$K_{2}$,打开弹簧夹$K_{3}$,引发喷泉的实验操作是
(2)弹簧夹$K_{2}导管末端需要连接NH_{3}$的尾气处理装置,则在弹簧夹$K_{2}$导管末端不能连接如图2-3所示的
用热毛巾捂住烧瓶一段时间(答案合理即可)
。完成喷泉实验后,装置D中充满液体,则装置D中溶液的物质的量浓度约为$ 0.045 mol/L $
(保留小数点后三位小数)。(2)弹簧夹$K_{2}导管末端需要连接NH_{3}$的尾气处理装置,则在弹簧夹$K_{2}$导管末端不能连接如图2-3所示的
Ⅰ
(填序号)装置。
答案:
(1)用热毛巾捂住烧瓶一段时间(答案合理即可) $ 0.045 mol/L $
(2)Ⅰ 解析:
(1) 受热时烧瓶内的压强增大,气体体积膨胀,压强迅速减小而形成喷泉,因此引发喷泉的操作可以是用热毛巾捂住烧瓶一段时间。设烧瓶 D 的体积为 1 L,则标准状况下 $ NH_{3} $ 的物质的量为 $ \frac{1}{22.4} mol $,溶于水后溶质的物质的量浓度为 $ \frac{\frac{1}{22.4} mol}{1 L} ≈ 0.045 mol/L $。
(2) $ NH_{3} $ 极易溶于水,易引发倒吸,因此要加防倒吸装置,Ⅱ和Ⅲ均能防倒吸,Ⅰ不能防倒吸。
(1)用热毛巾捂住烧瓶一段时间(答案合理即可) $ 0.045 mol/L $
(2)Ⅰ 解析:
(1) 受热时烧瓶内的压强增大,气体体积膨胀,压强迅速减小而形成喷泉,因此引发喷泉的操作可以是用热毛巾捂住烧瓶一段时间。设烧瓶 D 的体积为 1 L,则标准状况下 $ NH_{3} $ 的物质的量为 $ \frac{1}{22.4} mol $,溶于水后溶质的物质的量浓度为 $ \frac{\frac{1}{22.4} mol}{1 L} ≈ 0.045 mol/L $。
(2) $ NH_{3} $ 极易溶于水,易引发倒吸,因此要加防倒吸装置,Ⅱ和Ⅲ均能防倒吸,Ⅰ不能防倒吸。
查看更多完整答案,请扫码查看


