2025年高中假日必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高中假日必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
5.(2025.高一上重庆期末)下列离子方程式书写
正确的是 (
A.向Fe2(SO4)3溶液中加入足量镁粉:3Fe3++
2Mg= 3Fe+2Mg+
B.小苏打治疗胃酸过多:CO-+2H+= CO2↑
+H2O
C.过量CO2通入饱和Na2CO3溶液中:2Na++
$CO^2-+CO2+H2O= 2NaHCO+$
D.将C12通入石灰乳中制漂白粉:C12+2OH-
=C1O-+C1-+H2O
正确的是 (
C
)A.向Fe2(SO4)3溶液中加入足量镁粉:3Fe3++
2Mg= 3Fe+2Mg+
B.小苏打治疗胃酸过多:CO-+2H+= CO2↑
+H2O
C.过量CO2通入饱和Na2CO3溶液中:2Na++
$CO^2-+CO2+H2O= 2NaHCO+$
D.将C12通入石灰乳中制漂白粉:C12+2OH-
=C1O-+C1-+H2O
答案:
【解析】:
本题考查离子方程式的书写及正误判断。
A选项:向$Fe_{2}(SO_{4})_{3}$溶液中加入足量镁粉,镁会先和铁离子反应生成镁离子和铁,由于镁粉足量,最终铁离子会被完全置换出来。但离子方程式中电荷不守恒,且镁不能写成离子形式,正确的离子方程式应为:$2Fe^{3 +} + 3Mg=2Fe + 3Mg^{2 +}$,所以A选项错误。
B选项:小苏打是碳酸氢钠,治疗胃酸过多时,碳酸氢钠和胃酸(主要成分是盐酸)反应生成氯化钠、二氧化碳和水,离子方程式为:$HCO_{3}^{-} + H^{+}=CO_{2}\uparrow + H_{2}O$,B选项中碳酸氢根离子写成了$CO_{-}$,错误。
C选项:过量$CO_{2}$通入饱和$Na_{2}CO_{3}$溶液中,会生成碳酸氢钠晶体,因为碳酸氢钠的溶解度小于碳酸钠,且反应中钠离子不参与反应,离子方程式为:$2Na^{+} + CO_{3}^{2 -} + CO_{2} + H_{2}O = 2NaHCO_{3} \downarrow$(由于生成晶体,碳酸氢钠应写沉淀符号,不过本题选项中未写也可认为主要考查离子形式及反应本质),该选项离子方程式书写正确。
D选项:将$Cl_{2}$通入石灰乳中制漂白粉,石灰乳是氢氧化钙的悬浊液,不能拆写成离子形式,正确的离子方程式为:$Ca(OH)_{2} + Cl_{2}=ClO^{-} + Cl^{-} + H_{2}O+Ca^{2 +}$ ,所以D选项错误。
【答案】:
C
本题考查离子方程式的书写及正误判断。
A选项:向$Fe_{2}(SO_{4})_{3}$溶液中加入足量镁粉,镁会先和铁离子反应生成镁离子和铁,由于镁粉足量,最终铁离子会被完全置换出来。但离子方程式中电荷不守恒,且镁不能写成离子形式,正确的离子方程式应为:$2Fe^{3 +} + 3Mg=2Fe + 3Mg^{2 +}$,所以A选项错误。
B选项:小苏打是碳酸氢钠,治疗胃酸过多时,碳酸氢钠和胃酸(主要成分是盐酸)反应生成氯化钠、二氧化碳和水,离子方程式为:$HCO_{3}^{-} + H^{+}=CO_{2}\uparrow + H_{2}O$,B选项中碳酸氢根离子写成了$CO_{-}$,错误。
C选项:过量$CO_{2}$通入饱和$Na_{2}CO_{3}$溶液中,会生成碳酸氢钠晶体,因为碳酸氢钠的溶解度小于碳酸钠,且反应中钠离子不参与反应,离子方程式为:$2Na^{+} + CO_{3}^{2 -} + CO_{2} + H_{2}O = 2NaHCO_{3} \downarrow$(由于生成晶体,碳酸氢钠应写沉淀符号,不过本题选项中未写也可认为主要考查离子形式及反应本质),该选项离子方程式书写正确。
D选项:将$Cl_{2}$通入石灰乳中制漂白粉,石灰乳是氢氧化钙的悬浊液,不能拆写成离子形式,正确的离子方程式为:$Ca(OH)_{2} + Cl_{2}=ClO^{-} + Cl^{-} + H_{2}O+Ca^{2 +}$ ,所以D选项错误。
【答案】:
C
6.如表中评价合理的是 (
B
)
答案:
解:
A. 评价错误。NaHSO₄溶液与Ba(OH)₂溶液反应至SO₄²⁻沉淀完全,离子方程式应为H⁺ + SO₄²⁻ + Ba²⁺ + OH⁻ = BaSO₄↓ + H₂O。
B. 评价正确。碳酸镁为难溶物,不应拆写成CO₃²⁻,正确离子方程式为MgCO₃ + 2H⁺ = Mg²⁺ + CO₂↑ + H₂O。
C. 评价错误。向沸水中滴加饱和氯化铁溶液生成Fe(OH)₃胶体,离子方程式应为Fe³⁺ + 3H₂O =△= Fe(OH)₃(胶体) + 3H⁺。
D. 评价错误。NaOH溶液中通入少量CO₂,反应生成Na₂CO₃,离子方程式应为2OH⁻ + CO₂ = CO₃²⁻ + H₂O。
答案:B
A. 评价错误。NaHSO₄溶液与Ba(OH)₂溶液反应至SO₄²⁻沉淀完全,离子方程式应为H⁺ + SO₄²⁻ + Ba²⁺ + OH⁻ = BaSO₄↓ + H₂O。
B. 评价正确。碳酸镁为难溶物,不应拆写成CO₃²⁻,正确离子方程式为MgCO₃ + 2H⁺ = Mg²⁺ + CO₂↑ + H₂O。
C. 评价错误。向沸水中滴加饱和氯化铁溶液生成Fe(OH)₃胶体,离子方程式应为Fe³⁺ + 3H₂O =△= Fe(OH)₃(胶体) + 3H⁺。
D. 评价错误。NaOH溶液中通入少量CO₂,反应生成Na₂CO₃,离子方程式应为2OH⁻ + CO₂ = CO₃²⁻ + H₂O。
答案:B
7.写出下列反应的离子方程式。
(1)氢氧化钠溶液与硫酸溶液:
(2)氯化钠溶液与硝酸银溶液:
(3)氢氧化钡溶液和硫酸溶液:
(4)铁与硫酸铜溶液反应:
(5)碳酸钠溶液与氢氧化钙溶液反应:
(6)铁与稀盐酸反应:
(7)碳酸钠溶液与稀硫酸反应:
(1)氢氧化钠溶液与硫酸溶液:
$H^{+} + OH^{-} = H_{2}O$
;(2)氯化钠溶液与硝酸银溶液:
$Ag^{+} + Cl^{-} = AgCl \downarrow$
;(3)氢氧化钡溶液和硫酸溶液:
$Ba^{2+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} = BaSO_{4} \downarrow + 2H_{2}O$
;(4)铁与硫酸铜溶液反应:
$Fe + Cu^{2+} = Fe^{2+} + Cu$
;(5)碳酸钠溶液与氢氧化钙溶液反应:
$Ca^{2+} + CO_{3}^{2-} = CaCO_{3} \downarrow$
;(6)铁与稀盐酸反应:
$Fe + 2H^{+} = Fe^{2+} + H_{2} \uparrow$
;(7)碳酸钠溶液与稀硫酸反应:
$CO_{3}^{2-} + 2H^{+} = CO_{2} \uparrow + H_{2}O$
。
答案:
【解析】:
本题考查离子方程式的书写,需要掌握各类物质在溶液中的存在形式以及离子反应的实质。
(1)氢氧化钠溶液与硫酸溶液反应,实质是氢氧根离子与氢离子反应生成水。
(2)氯化钠溶液与硝酸银溶液反应,实质是氯离子与银离子反应生成氯化银沉淀。
(3)氢氧化钡溶液和硫酸溶液反应,实质是钡离子与硫酸根离子反应生成硫酸钡沉淀,同时氢氧根离子与氢离子反应生成水。
(4)铁与硫酸铜溶液反应,实质是铁置换出硫酸铜中的铜,生成亚铁离子和铜。
(5)碳酸钠溶液与氢氧化钙溶液反应,实质是碳酸根离子与钙离子反应生成碳酸钙沉淀,同时生成氢氧根离子。但需要注意,由于氢氧化钙是微溶物,在澄清溶液中应拆写成离子形式,在浊液中应保留化学式,本题未指明是澄清还是浊液,一般默认按澄清处理,但考虑到碳酸钙的生成,我们主要关注碳酸根离子与钙离子的反应。
(6)铁与稀盐酸反应,实质是铁置换出盐酸中的氢,生成亚铁离子和氢气。
(7)碳酸钠溶液与稀硫酸反应,实质是碳酸根离子与氢离子反应生成二氧化碳和水。
【答案】:
(1)$H^{+} + OH^{-} = H_{2}O$
(2)$Ag^{+} + Cl^{-} = AgCl \downarrow$
(3)$Ba^{2+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} = BaSO_{4} \downarrow + 2H_{2}O$
(4)$Fe + Cu^{2+} = Fe^{2+} + Cu$
(5)$Ca^{2+} + CO_{3}^{2-} = CaCO_{3} \downarrow$(注意,这里未写出氢氧根离子,因为在澄清溶液中,氢氧根离子不参与主要反应,且氢氧化钙的溶解度较小,主要以钙离子和氢氧根离子的形式存在,但在此反应中,我们主要关注碳酸钙的生成)
(6)$Fe + 2H^{+} = Fe^{2+} + H_{2} \uparrow$
(7)$CO_{3}^{2-} + 2H^{+} = CO_{2} \uparrow + H_{2}O$
本题考查离子方程式的书写,需要掌握各类物质在溶液中的存在形式以及离子反应的实质。
(1)氢氧化钠溶液与硫酸溶液反应,实质是氢氧根离子与氢离子反应生成水。
(2)氯化钠溶液与硝酸银溶液反应,实质是氯离子与银离子反应生成氯化银沉淀。
(3)氢氧化钡溶液和硫酸溶液反应,实质是钡离子与硫酸根离子反应生成硫酸钡沉淀,同时氢氧根离子与氢离子反应生成水。
(4)铁与硫酸铜溶液反应,实质是铁置换出硫酸铜中的铜,生成亚铁离子和铜。
(5)碳酸钠溶液与氢氧化钙溶液反应,实质是碳酸根离子与钙离子反应生成碳酸钙沉淀,同时生成氢氧根离子。但需要注意,由于氢氧化钙是微溶物,在澄清溶液中应拆写成离子形式,在浊液中应保留化学式,本题未指明是澄清还是浊液,一般默认按澄清处理,但考虑到碳酸钙的生成,我们主要关注碳酸根离子与钙离子的反应。
(6)铁与稀盐酸反应,实质是铁置换出盐酸中的氢,生成亚铁离子和氢气。
(7)碳酸钠溶液与稀硫酸反应,实质是碳酸根离子与氢离子反应生成二氧化碳和水。
【答案】:
(1)$H^{+} + OH^{-} = H_{2}O$
(2)$Ag^{+} + Cl^{-} = AgCl \downarrow$
(3)$Ba^{2+} + 2OH^{-} + 2H^{+} + SO_{4}^{2-} = BaSO_{4} \downarrow + 2H_{2}O$
(4)$Fe + Cu^{2+} = Fe^{2+} + Cu$
(5)$Ca^{2+} + CO_{3}^{2-} = CaCO_{3} \downarrow$(注意,这里未写出氢氧根离子,因为在澄清溶液中,氢氧根离子不参与主要反应,且氢氧化钙的溶解度较小,主要以钙离子和氢氧根离子的形式存在,但在此反应中,我们主要关注碳酸钙的生成)
(6)$Fe + 2H^{+} = Fe^{2+} + H_{2} \uparrow$
(7)$CO_{3}^{2-} + 2H^{+} = CO_{2} \uparrow + H_{2}O$
8.现有含NaC1、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO:溶液。相应的实验过程可用下图表示:
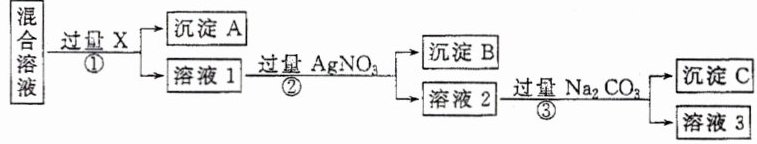
请回答下列问题:
(1)试剂X最好是
(2)写出步骤②反应的离子方程式:
(3)按此实验方案得到的溶液3中肯定含有

请回答下列问题:
(1)试剂X最好是
Ba(NO₃)₂
(填化学式),检验X是否加入过量的方法是取少量溶液1于试管中,滴加稀硫酸,若产生白色沉淀,则说明Ba(NO₃)₂过量
。(2)写出步骤②反应的离子方程式:
Ag⁺ + Cl⁻ = AgCl↓
。(3)按此实验方案得到的溶液3中肯定含有
Na₂CO₃
(填化学式,下同)杂质;为了除去该杂质,可以向溶液3中加入适量的稀硝酸
,之后若要获得纯NaNO固体,还需进行的实验操作是蒸发结晶
(填操作名称)。
答案:
【解析】:
本题主要考查物质的分离、提纯以及离子方程式的书写,涉及除杂试剂的选择、离子检验、离子方程式的书写以及物质的分离操作等知识点。
(1)试剂X的选择及过量检验方法:
要除去溶液中的$NaCl$和$Na_2SO_4$,需要分别除去$Cl^-$和$SO_4^{2 - }$。除去$SO_4^{2 - }$常用$Ba^{2 + }$,为了不引入新的杂质,试剂$X$最好是$Ba(NO_3)_2$。
检验$Ba(NO_3)_2$是否加入过量的方法是:取少量溶液$1$于试管中,滴加稀硫酸,若产生白色沉淀,则说明$Ba(NO_3)_2$过量。
(2)步骤②反应的离子方程式:
步骤②是向溶液$1$中加入过量的$AgNO_3$,目的是除去$Cl^-$,发生反应的离子方程式为$Ag^+ + Cl^- = AgCl\downarrow$。
(3)溶液$3$中杂质及除杂方法和后续操作:
由于步骤①中加入了过量的$Ba(NO_3)_2$,步骤②中加入了过量的$AgNO_3$,步骤③中加入了过量的$Na_2CO_3$,$Na_2CO_3$与$Ba(NO_3)_2$、$AgNO_3$反应后,溶液$3$中肯定含有$Na_2CO_3$杂质。
为了除去$Na_2CO_3$,可以向溶液$3$中加入适量的稀硝酸,发生反应$2H^+ + CO_3^{2 - } = H_2O + CO_2\uparrow$。
之后若要获得纯$NaNO_3$固体,还需进行的实验操作是蒸发结晶,通过蒸发溶剂使$NaNO_3$结晶析出。
【答案】:
(1)$Ba(NO_3)_2$;取少量溶液$1$于试管中,滴加稀硫酸,若产生白色沉淀,则说明$Ba(NO_3)_2$过量
(2)$Ag^+ + Cl^- = AgCl\downarrow$
(3)$Na_2CO_3$;稀硝酸;蒸发结晶
本题主要考查物质的分离、提纯以及离子方程式的书写,涉及除杂试剂的选择、离子检验、离子方程式的书写以及物质的分离操作等知识点。
(1)试剂X的选择及过量检验方法:
要除去溶液中的$NaCl$和$Na_2SO_4$,需要分别除去$Cl^-$和$SO_4^{2 - }$。除去$SO_4^{2 - }$常用$Ba^{2 + }$,为了不引入新的杂质,试剂$X$最好是$Ba(NO_3)_2$。
检验$Ba(NO_3)_2$是否加入过量的方法是:取少量溶液$1$于试管中,滴加稀硫酸,若产生白色沉淀,则说明$Ba(NO_3)_2$过量。
(2)步骤②反应的离子方程式:
步骤②是向溶液$1$中加入过量的$AgNO_3$,目的是除去$Cl^-$,发生反应的离子方程式为$Ag^+ + Cl^- = AgCl\downarrow$。
(3)溶液$3$中杂质及除杂方法和后续操作:
由于步骤①中加入了过量的$Ba(NO_3)_2$,步骤②中加入了过量的$AgNO_3$,步骤③中加入了过量的$Na_2CO_3$,$Na_2CO_3$与$Ba(NO_3)_2$、$AgNO_3$反应后,溶液$3$中肯定含有$Na_2CO_3$杂质。
为了除去$Na_2CO_3$,可以向溶液$3$中加入适量的稀硝酸,发生反应$2H^+ + CO_3^{2 - } = H_2O + CO_2\uparrow$。
之后若要获得纯$NaNO_3$固体,还需进行的实验操作是蒸发结晶,通过蒸发溶剂使$NaNO_3$结晶析出。
【答案】:
(1)$Ba(NO_3)_2$;取少量溶液$1$于试管中,滴加稀硫酸,若产生白色沉淀,则说明$Ba(NO_3)_2$过量
(2)$Ag^+ + Cl^- = AgCl\downarrow$
(3)$Na_2CO_3$;稀硝酸;蒸发结晶
1.(2023.北京卷)下列离子方程式与所给事实不相符的是 (
A.Cl2制备84消毒液(主要成分是NaClO):
Cl2+2OH-= CI-+C1O-+HO
B.食醋去除水垢中的CaCO3:CaCO3+2H+
$ Ca^2++H2O+CO2↑$
C.利用覆铜板制作印刷电路板:2Fe3++Cu=
$ 2Fe2++Cu^2+$
D.Na2S去除废水中的$Hg^2+:Hg^2++S^2-= =$
HgS
B
)A.Cl2制备84消毒液(主要成分是NaClO):
Cl2+2OH-= CI-+C1O-+HO
B.食醋去除水垢中的CaCO3:CaCO3+2H+
$ Ca^2++H2O+CO2↑$
C.利用覆铜板制作印刷电路板:2Fe3++Cu=
$ 2Fe2++Cu^2+$
D.Na2S去除废水中的$Hg^2+:Hg^2++S^2-= =$
HgS
答案:
【解析】:
本题考查离子方程式的书写及正误判断。
A选项:描述的是氯气与氢氧化钠溶液的反应,这是制备84消毒液(主要成分是$NaClO$)的常用方法。离子方程式$Cl_{2} + 2OH^{-} = Cl^{-} + ClO^{-} + H_{2}O$准确地表示了这个反应,其中氯气分子接受一个氢氧根离子的电子成为氯离子,同时另一个氢氧根离子与氯气分子中的另一个氯原子结合形成次氯酸根离子和水。这个离子方程式是正确的。
B选项:描述的是食醋(主要成分是醋酸)与碳酸钙的反应,用于去除水垢。然而,给出的离子方程式$CaCO_{3} + 2H^{+} = Ca^{2+} + H_{2}O + CO_{2} \uparrow$并不准确,因为醋酸是弱酸,在离子方程式中不能拆分为氢离子和醋酸根离子。正确的离子方程式应该包含醋酸分子,即$CaCO_{3} + 2CH_{3}COOH = Ca^{2+} + H_{2}O + CO_{2} \uparrow + 2CH_{3}COO^{-}$。因此,B选项是错误的。
C选项:描述的是利用覆铜板制作印刷电路板时,铁离子与铜的反应。离子方程式$2Fe^{3+} + Cu = 2Fe^{2+} + Cu^{2+}$准确地表示了这个反应,其中铁离子接受铜的电子成为亚铁离子,同时铜被氧化为铜离子。这个离子方程式是正确的。
D选项:描述的是硫化钠去除废水中的汞离子的反应。离子方程式$Hg^{2+} + S^{2-} = HgS$准确地表示了这个反应,其中汞离子与硫离子结合形成不溶于水的硫化汞沉淀。这个离子方程式是正确的。
综上所述,与所给事实不相符的离子方程式是B选项。
【答案】:
B。
本题考查离子方程式的书写及正误判断。
A选项:描述的是氯气与氢氧化钠溶液的反应,这是制备84消毒液(主要成分是$NaClO$)的常用方法。离子方程式$Cl_{2} + 2OH^{-} = Cl^{-} + ClO^{-} + H_{2}O$准确地表示了这个反应,其中氯气分子接受一个氢氧根离子的电子成为氯离子,同时另一个氢氧根离子与氯气分子中的另一个氯原子结合形成次氯酸根离子和水。这个离子方程式是正确的。
B选项:描述的是食醋(主要成分是醋酸)与碳酸钙的反应,用于去除水垢。然而,给出的离子方程式$CaCO_{3} + 2H^{+} = Ca^{2+} + H_{2}O + CO_{2} \uparrow$并不准确,因为醋酸是弱酸,在离子方程式中不能拆分为氢离子和醋酸根离子。正确的离子方程式应该包含醋酸分子,即$CaCO_{3} + 2CH_{3}COOH = Ca^{2+} + H_{2}O + CO_{2} \uparrow + 2CH_{3}COO^{-}$。因此,B选项是错误的。
C选项:描述的是利用覆铜板制作印刷电路板时,铁离子与铜的反应。离子方程式$2Fe^{3+} + Cu = 2Fe^{2+} + Cu^{2+}$准确地表示了这个反应,其中铁离子接受铜的电子成为亚铁离子,同时铜被氧化为铜离子。这个离子方程式是正确的。
D选项:描述的是硫化钠去除废水中的汞离子的反应。离子方程式$Hg^{2+} + S^{2-} = HgS$准确地表示了这个反应,其中汞离子与硫离子结合形成不溶于水的硫化汞沉淀。这个离子方程式是正确的。
综上所述,与所给事实不相符的离子方程式是B选项。
【答案】:
B。
2.(2024.浙江1月卷)下列物质
是 (
A.CO2
B.HC1
C.NaOH
D.BaSO4
不
属
于
电解质的是 (
A
)A.CO2
B.HC1
C.NaOH
D.BaSO4
答案:
【解析】:
本题考查电解质的概念及判断。电解质是指在水溶液中或熔融状态下能够导电的化合物。我们需要分析每个选项中的物质是否满足电解质的定义。
A. $CO_{2}$:二氧化碳在水溶液中生成碳酸,碳酸能导电,但二氧化碳本身并不直接电离出离子来导电,所以二氧化碳是非电解质。
B. $HCl$:氯化氢在水溶液中能够完全电离出氢离子和氯离子,因此能够导电,是电解质。
C. $NaOH$:氢氧化钠在水溶液中能够完全电离出钠离子和氢氧根离子,因此能够导电,是电解质。
D. $BaSO_{4}$:硫酸钡虽然在水中的溶解度很小,但在熔融状态下能够完全电离出钡离子和硫酸根离子,因此是电解质。
根据以上分析,只有$CO_{2}$不属于电解质。
【答案】:
A
本题考查电解质的概念及判断。电解质是指在水溶液中或熔融状态下能够导电的化合物。我们需要分析每个选项中的物质是否满足电解质的定义。
A. $CO_{2}$:二氧化碳在水溶液中生成碳酸,碳酸能导电,但二氧化碳本身并不直接电离出离子来导电,所以二氧化碳是非电解质。
B. $HCl$:氯化氢在水溶液中能够完全电离出氢离子和氯离子,因此能够导电,是电解质。
C. $NaOH$:氢氧化钠在水溶液中能够完全电离出钠离子和氢氧根离子,因此能够导电,是电解质。
D. $BaSO_{4}$:硫酸钡虽然在水中的溶解度很小,但在熔融状态下能够完全电离出钡离子和硫酸根离子,因此是电解质。
根据以上分析,只有$CO_{2}$不属于电解质。
【答案】:
A
查看更多完整答案,请扫码查看


