2025年高中假日必刷题高一化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年高中假日必刷题高一化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
3. 用石灰乳吸收硝酸工业的尾气(含 $ {NO} $、$ {NO_{2}} $,$ {NO} $ 和 $ {NO_{2}} $ 物质的量之比接近 $ 1:1 $)可获得 $ {Ca(NO_{2})_{2}} $,部分工艺流程如下,下列说法不正确的是(

A.吸收时主要反应的离子方程式为 $ {NO + NO_{2} + 2OH^{-} \xlongequal{} 2NO^{-}_{2} + H_{2}O} $
B.用石灰乳比用澄清石灰水吸收效果更好
C.采用气液逆流接触有利于尾气中 $ {NO} $、$ {NO_{2}} $ 的充分吸收
D.尾气中含有的 $ {NO_{2}} $ 不是酸性氧化物
A
)
A.吸收时主要反应的离子方程式为 $ {NO + NO_{2} + 2OH^{-} \xlongequal{} 2NO^{-}_{2} + H_{2}O} $
B.用石灰乳比用澄清石灰水吸收效果更好
C.采用气液逆流接触有利于尾气中 $ {NO} $、$ {NO_{2}} $ 的充分吸收
D.尾气中含有的 $ {NO_{2}} $ 不是酸性氧化物
答案:
A 该工艺中NO和NO₂物质的量之比接近1:1,且反应生成Ca(NO₂)₂,则反应方程式为NO + NO₂ + Ca(OH)₂ = Ca(NO₂)₂ + H₂O;若n(NO):n(NO₂)>1:1,多余的NO无法被Ca(OH)₂吸收,造成排放气体中NO含量升高;若n(NO):n(NO₂)<1:1,二氧化氮过量,被Ca(OH)₂吸收,则发生了4NO₂ + Ca(OH)₂ = Ca(NO₃)₂ + Ca(NO₂)₂ + 2H₂O,产品中Ca(NO₃)₂含量升高;A.根据分析过程,该工艺中NO和NO₂物质的量之比接近1:1,可以提高Ca(NO₂)₂的产率及纯度,石灰乳中氢氧化钙为浊液不能拆开,吸收时主要反应离子方程式为NO + NO₂ + Ca(OH)₂ = Ca²⁺ + 2NO₂⁻ + H₂O,故A错误;石灰乳更利于气体附着,改为澄清石灰水吸收效率将会降低,故B正确;采用气液逆流接触,增大了气体和石灰乳的接触面积,有利于尾气中NO、NO₂的充分吸收,故C正确;二氧化氮和水生成硝酸和一氧化氮,不是酸性氧化物,故D正确。
4. 氮及其化合物的价类二维图如图所示,下列有关说法正确的是(
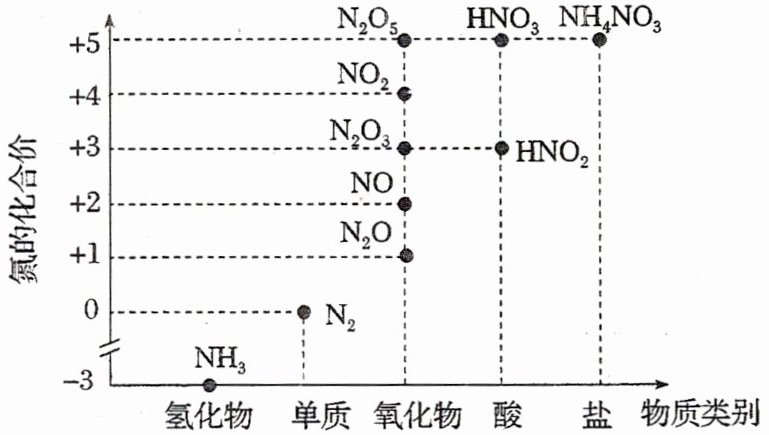
A.实验室 $ {NH_{3}} $ 可由 $ {NH_{4}NO_{3}} $ 固体分解制取
B.$ {N_{2}} $ 生成 $ {NH_{3}} $ 的过程属于氮的固定
C.“雷雨发庄稼”的原理为 $ {N_{2} \to NO \to NO_{2} \to HNO_{3}} $
D.向浓 $ {HNO_{3}} $ 中投入红热的木炭,产生红棕色气体,一定可以证明 $ {NO_{2}} $ 产生于木炭与浓 $ {HNO_{3}} $ 的反应
B
)
A.实验室 $ {NH_{3}} $ 可由 $ {NH_{4}NO_{3}} $ 固体分解制取
B.$ {N_{2}} $ 生成 $ {NH_{3}} $ 的过程属于氮的固定
C.“雷雨发庄稼”的原理为 $ {N_{2} \to NO \to NO_{2} \to HNO_{3}} $
D.向浓 $ {HNO_{3}} $ 中投入红热的木炭,产生红棕色气体,一定可以证明 $ {NO_{2}} $ 产生于木炭与浓 $ {HNO_{3}} $ 的反应
答案:
B NH₄NO₃固体分解会得到多种气体,不能用NH₄NO₃固体分解制取NH₃,A错误;氮的固定是将游离态的氮转化为化合态的氮的过程,N₂生成NH₃的过程属于氮的固定,B正确;“雷雨发庄稼”的原理为N₂ + O₂$\xlongequal{高温或放电}$2NO、2NO + O₂ = 2NO₂、3NO₂ + H₂O = 2HNO₃ + NO、HNO₃生成盐,C错误;向浓HNO₃中投入红热的木炭,产生红棕色气体,可能是木炭可与浓HNO₃反应生成NO₂,也可能是浓硝酸受热分解产出了NO₂,D错误;故选B。
5. 向 $ 27.2 \, \text{g} \, {Cu} $ 和 $ {Cu_{2}O} $ 的混合物中加入 $ 0.5 \, \text{L} $ 某浓度的稀硝酸,固体物质完全反应,生成 $ {NO} $ 和 $ {Cu(NO_{3})_{2}} $。在所得溶液中加入 $ 1.0 \, \text{L} \, 1.0 \, \text{mol/L} $ 的 $ {NaOH} $ 溶液,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 $ 39.2 \, \text{g} $。下列说法不正确的是(
A.$ {Cu} $ 与 $ {Cu_{2}O} $ 的物质的量之比为 $ 2:1 $
B.硝酸的物质的量的浓度为 $ 2.6 \, \text{mol/L} $
C.产生的 $ {NO} $ 在标准状况下的体积为 $ 4.48 \, \text{L} $
D.$ {Cu} $、$ {Cu_{2}O} $ 与硝酸反应后剩余的 $ {HNO_{3}} $ 为 $ 0.2 \, \text{mol} $
B
)A.$ {Cu} $ 与 $ {Cu_{2}O} $ 的物质的量之比为 $ 2:1 $
B.硝酸的物质的量的浓度为 $ 2.6 \, \text{mol/L} $
C.产生的 $ {NO} $ 在标准状况下的体积为 $ 4.48 \, \text{L} $
D.$ {Cu} $、$ {Cu_{2}O} $ 与硝酸反应后剩余的 $ {HNO_{3}} $ 为 $ 0.2 \, \text{mol} $
答案:
B 设Cu和Cu₂O的物质的量分别为x、y,最后得到的39.2 g沉淀为Cu(OH)₂,则有64x + 144y = 27.2 g,(x + 2y)×98 g·mol⁻¹ = 39.2 g,联立两式解得:x = 0.2,y = 0.1,故Cu与Cu₂O的物质的量之比为0.2 mol:0.1 mol = 2:1,A正确;据Cu原子守恒可知,反应生成Cu(NO₃)₂的物质的量为0.2 mol + 0.1 mol×2 = 0.4 mol,反应中失电子的总物质的量为0.2 mol×2 + 0.1 mol×2×1 = 0.6 mol,据得失电子守恒推知,反应生成NO为0.2 mol,NO在标准状况下的体积为0.2 mol×22.4 L/mol = 4.48 L,C正确;金属离子恰好沉淀时,溶液中的溶质为NaNO₃,原硝酸溶液中n(HNO₃)=n(NaNO₃)+n(NO)=1.0 mol/L×1.0 L + 0.2 mol = 1.2 mol,故c(HNO₃)=$\frac{1.2mol}{0.5L}$ = 2.4 mol/L,B错误;结合N原子守恒可知,Cu、Cu₂O与硝酸反应后剩余的HNO₃为n(NaNO₃) - 2n[Cu(NO₃)₂]=1.0 mol - 2×0.4 mol = 0.2 mol,D正确。
6. 一种借用 $ {CeO_{2}/CeO_{2 - x}} $ 的转化,消除 $ {NH_{3}} $、$ {NO} $ 气体污染的途径如图所示。下列说法不正确的是(
A.反应①是一个非氧化还原反应
B.反应②中 $ {N_{2}} $ 只是氧化产物
C.利用上述转化有利于缓解温室效应
D.该过程的总反应可能为 $ {4NH_{3} + 2NO + 2O_{2} \xlongequal{} 3N_{2} + 6H_{2}O} $
D
)A.反应①是一个非氧化还原反应
B.反应②中 $ {N_{2}} $ 只是氧化产物
C.利用上述转化有利于缓解温室效应
D.该过程的总反应可能为 $ {4NH_{3} + 2NO + 2O_{2} \xlongequal{} 3N_{2} + 6H_{2}O} $
答案:
D 反应①过程中有氧气生成,O元素的化合价在反应过程中发生变化,是一个氧化还原反应,故A错误;由图示可知,反应②中反应物NH₃、NO中的N元素化合价分别由-3价、+2价变为0价,氮元素的化合价既升高又降低,则N₂既是氧化产物又是还原产物,故B错误;温室效应主要由二氧化碳引起的,上述转化过程中没有二氧化碳参与转化,不能改变大气中二氧化碳的含量,不能缓解温室效应,故C错误;由图示中的转化关系可知,NH₃、NO、O₂反应生成N₂、H₂O,根据得失电子守恒和原子守恒配平该过程的总反应为4NH₃ + 2NO + 2O₂ = 3N₂ + 6H₂O,故D正确。
查看更多完整答案,请扫码查看


