2025年暑假Happy假日八年级化学通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假Happy假日八年级化学通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第108页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
2. 《天工开物》对钢铁冶炼过程有如下记载。下列有关说法正确的是 (
C
)
答案:
【解析】:
- 选项A:地壳中含量最高的金属元素是铝元素,不是铁元素,A错误。
- 选项B:$Fe_{2}O_{3}$难溶于水,B错误。
- 选项C:冶炼铁的过程中有新物质生成,发生了化学变化,C正确。
- 选项D:生铁高温锻打时,碳与氧气反应生成二氧化碳,碳元素含量降低,D错误。
【答案】:C
- 选项A:地壳中含量最高的金属元素是铝元素,不是铁元素,A错误。
- 选项B:$Fe_{2}O_{3}$难溶于水,B错误。
- 选项C:冶炼铁的过程中有新物质生成,发生了化学变化,C正确。
- 选项D:生铁高温锻打时,碳与氧气反应生成二氧化碳,碳元素含量降低,D错误。
【答案】:C
3. 工业炼铁可利用一氧化碳与氧化铁反应。若要生产含铁$97\%的生铁231t$,需含氧化铁$80\%$的赤铁矿石的质量最接近 (
A. $224t$
B. $280t$
C. $320t$
D. $400t$
D
)A. $224t$
B. $280t$
C. $320t$
D. $400t$
答案:
【解析】:本题可先根据生铁的质量及含铁量计算出铁的质量,再根据一氧化碳与氧化铁反应的化学方程式,由铁的质量求出氧化铁的质量,最后根据赤铁矿石中氧化铁的质量分数求出赤铁矿石的质量。
- **步骤一:计算$231t$含铁$97\%$的生铁中铁的质量**
生铁中铁的质量$=$生铁的质量$×$生铁中铁的质量分数,即$231t×97\% = 224.07t$。
- **步骤二:设需要氧化铁的质量为$x$,根据化学方程式计算氧化铁的质量**
一氧化碳与氧化铁反应的化学方程式为$Fe_{2}O_{3}+3CO\xlongequal{高温}2Fe + 3CO_{2}$。
根据化学方程式可知,氧化铁与生成铁的质量比为$(56×2 + 16×3):(56×2)=160:112$。
已知生成铁的质量为$224.07t$,可列出比例式$\dfrac{160}{112}=\dfrac{x}{224.07t}$,解得$x = \dfrac{160×224.07t}{112}= 320.1t$。
- **步骤三:计算含氧化铁$80\%$的赤铁矿石的质量**
赤铁矿石的质量$=$氧化铁的质量$÷$赤铁矿石中氧化铁的质量分数,即$320.1t÷80\% = 400.125t\approx400t$。
【答案】:D
- **步骤一:计算$231t$含铁$97\%$的生铁中铁的质量**
生铁中铁的质量$=$生铁的质量$×$生铁中铁的质量分数,即$231t×97\% = 224.07t$。
- **步骤二:设需要氧化铁的质量为$x$,根据化学方程式计算氧化铁的质量**
一氧化碳与氧化铁反应的化学方程式为$Fe_{2}O_{3}+3CO\xlongequal{高温}2Fe + 3CO_{2}$。
根据化学方程式可知,氧化铁与生成铁的质量比为$(56×2 + 16×3):(56×2)=160:112$。
已知生成铁的质量为$224.07t$,可列出比例式$\dfrac{160}{112}=\dfrac{x}{224.07t}$,解得$x = \dfrac{160×224.07t}{112}= 320.1t$。
- **步骤三:计算含氧化铁$80\%$的赤铁矿石的质量**
赤铁矿石的质量$=$氧化铁的质量$÷$赤铁矿石中氧化铁的质量分数,即$320.1t÷80\% = 400.125t\approx400t$。
【答案】:D
4. 《天工开物》描述了锡和锌的冶炼方法,下列说法不正确的是 (
炼锡: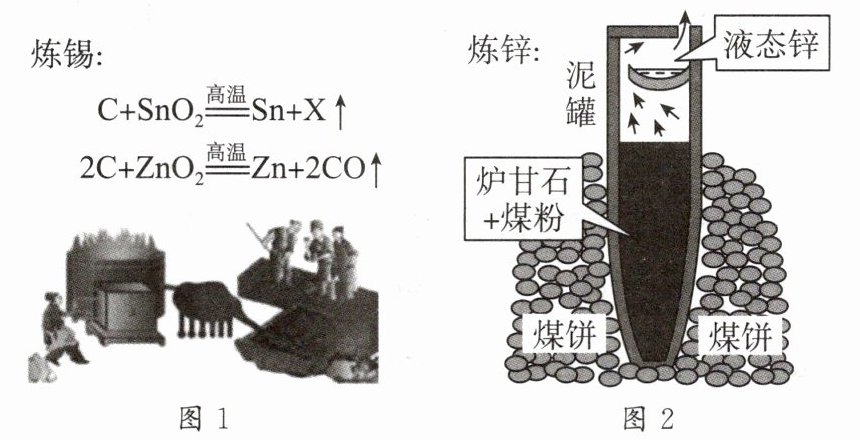
A. 图1中X为$CO_{2}$
B. 图1炼锡时混入少许铅形成合金,产物更难熔化流出
C. 图2泥罐外煤饼的主要作用是燃烧提高热量
D. 图2必须冷却后才能取锌,是为了防止锌在较高的温度下又被氧化
B
)炼锡:

A. 图1中X为$CO_{2}$
B. 图1炼锡时混入少许铅形成合金,产物更难熔化流出
C. 图2泥罐外煤饼的主要作用是燃烧提高热量
D. 图2必须冷却后才能取锌,是为了防止锌在较高的温度下又被氧化
答案:
【解析】:
- 选项A:根据质量守恒定律,化学反应前后原子的种类和数目不变,炼锡反应$C + SnO_{2}\xlongequal{高温}Sn + X\uparrow$中,反应前$C$、$Sn$、$O$原子个数分别为$1$、$1$、$2$,反应后已知$Sn$原子个数为$1$,则$X$中含有$1$个$C$原子和$2$个$O$原子,所以$X$为$CO_{2}$,A正确。
- 选项B:合金的熔点比组成它的纯金属的熔点低,炼锡时混入少许铅形成合金,产物更容易熔化流出,B错误。
- 选项C:图2泥罐外煤饼燃烧放出大量的热,主要作用是燃烧提高热量,C正确。
- 选项D:锌在较高温度下易被氧化,所以图2必须冷却后才能取锌,D正确。
【答案】:B
- 选项A:根据质量守恒定律,化学反应前后原子的种类和数目不变,炼锡反应$C + SnO_{2}\xlongequal{高温}Sn + X\uparrow$中,反应前$C$、$Sn$、$O$原子个数分别为$1$、$1$、$2$,反应后已知$Sn$原子个数为$1$,则$X$中含有$1$个$C$原子和$2$个$O$原子,所以$X$为$CO_{2}$,A正确。
- 选项B:合金的熔点比组成它的纯金属的熔点低,炼锡时混入少许铅形成合金,产物更容易熔化流出,B错误。
- 选项C:图2泥罐外煤饼燃烧放出大量的热,主要作用是燃烧提高热量,C正确。
- 选项D:锌在较高温度下易被氧化,所以图2必须冷却后才能取锌,D正确。
【答案】:B
5. 钢铁在生产生活中应用广泛。结合工业炼铁的简易流程图,回答下列问题: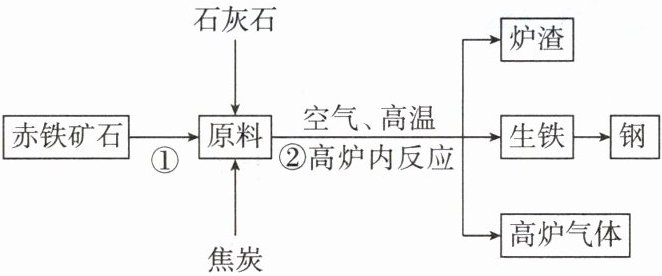
(1)为增大反应物的接触面积,使反应更充分,①处的具体措施是
(2)每年有大量金属因腐蚀而报废,防止铁生锈的方法有
(3)写出工业炼铁主要反应原理的化学方程式
(4)生铁和钢的性能不同,原因是
(5)请对高炉气体的处理提出合理化建议

(1)为增大反应物的接触面积,使反应更充分,①处的具体措施是
粉碎赤铁矿石
。(2)每年有大量金属因腐蚀而报废,防止铁生锈的方法有
刷漆(或涂油、保持铁制品表面洁净干燥等)
。(3)写出工业炼铁主要反应原理的化学方程式
$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
。(4)生铁和钢的性能不同,原因是
含碳量不同
。(5)请对高炉气体的处理提出合理化建议
回收利用(或作燃料等)
。
答案:
(1)粉碎赤铁矿石
(2)刷漆(或涂油、保持铁制品表面洁净干燥等)
(3)$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
(4)含碳量不同
(5)回收利用(或作燃料等)
(1)粉碎赤铁矿石
(2)刷漆(或涂油、保持铁制品表面洁净干燥等)
(3)$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
(4)含碳量不同
(5)回收利用(或作燃料等)
查看更多完整答案,请扫码查看


