2025年暑假Happy假日八年级化学通用版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年暑假Happy假日八年级化学通用版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
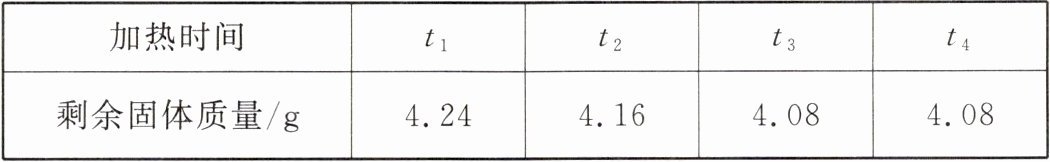
12. 某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与$1g$二氧化锰混合,其总质量为$6g$。依次加热该混合物$t_{1}$、$t_{2}$、$t_{3}$、$t_{4}$时间后,分别冷却并称量剩余固体的质量,记录的有关数据如下表所示(提示:氯酸钾在二氧化锰作催化剂并加热的条件下发生反应的化学方程式为$2KClO_{3}\underset{\triangle}{\overset{MnO_{2}}{\!=\!=\!=\!=\!=}}2KCl+3O_{2}\uparrow$,样品中的杂质不参与化学反应)。
试计算:
(1)完全反应后产生氧气的总质量为______
(2)样品中氯酸钾的纯度。

试计算:
(1)完全反应后产生氧气的总质量为______
1.92g
。(2)样品中氯酸钾的纯度。
98%
答案:
【解析】:
(1)根据质量守恒定律,反应前后物质的总质量不变。反应前混合物总质量为$6g$,完全反应后剩余固体质量为$4.08g$,则生成氧气的总质量为$6g - 4.08g = 1.92g$。
(2)设样品中氯酸钾的质量为$x$。
$2KClO_{3}\underset{\triangle}{\overset{MnO_{2}}{\!=\!=\!=\!=\!=}}2KCl + 3O_{2}\uparrow$
$245$ $96$
$x$ $1.92g$
$\dfrac{245}{96}=\dfrac{x}{1.92g}$,解得$x = 4.9g$。
样品质量为$6g - 1g = 5g$,则样品中氯酸钾的纯度为$\dfrac{4.9g}{5g}×100\% = 98\%$。
【答案】:
(1)$1.92g$
(2)$98\%$
(1)根据质量守恒定律,反应前后物质的总质量不变。反应前混合物总质量为$6g$,完全反应后剩余固体质量为$4.08g$,则生成氧气的总质量为$6g - 4.08g = 1.92g$。
(2)设样品中氯酸钾的质量为$x$。
$2KClO_{3}\underset{\triangle}{\overset{MnO_{2}}{\!=\!=\!=\!=\!=}}2KCl + 3O_{2}\uparrow$
$245$ $96$
$x$ $1.92g$
$\dfrac{245}{96}=\dfrac{x}{1.92g}$,解得$x = 4.9g$。
样品质量为$6g - 1g = 5g$,则样品中氯酸钾的纯度为$\dfrac{4.9g}{5g}×100\% = 98\%$。
【答案】:
(1)$1.92g$
(2)$98\%$
13. 现有$6g$镁分别与不同质量的氧气反应,试将生成氧化镁的质量填入下表,并通过计算回答下列问题。
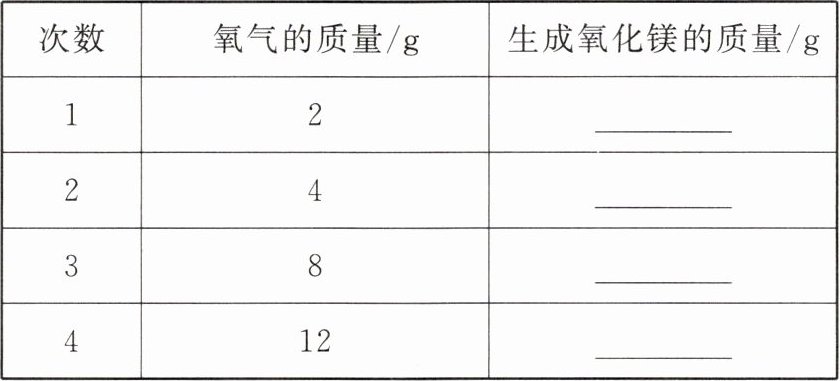
(1)第一次实验中,$6g镁和2g氧气反应为什么不能生成8g$氧化镁?
(2)第二次实验以后,为什么增加氧气的质量,生成氧化镁的质量却不再增加?
(表格中对应空格依次填入:

(1)第一次实验中,$6g镁和2g氧气反应为什么不能生成8g$氧化镁?
(2)第二次实验以后,为什么增加氧气的质量,生成氧化镁的质量却不再增加?
(表格中对应空格依次填入:
10
;10
;10
;10
)
答案:
【解析】:
根据镁与氧气反应的化学方程式$2Mg + O_{2}\xlongequal{点燃}2MgO$,可知镁、氧气、氧化镁的质量比为$(2×24):(16×2):(2×(24 + 16)) = 3:2:5$。
当氧气质量为$2g$时,设生成氧化镁质量为$x$,根据质量比$3:5 = 6g:x$,解得$x = 10g$。
当氧气质量为$4g$时,$6g$镁与$4g$氧气恰好完全反应,根据质量比生成氧化镁质量为$10g$。
当氧气质量为$8g$时,$6g$镁只能消耗$4g$氧气,生成氧化镁质量仍为$10g$。
当氧气质量为$12g$时,$6g$镁还是只能消耗$4g$氧气,生成氧化镁质量还是$10g$。
(1)根据化学方程式可知镁、氧气反应时的质量比为$3:2$,$6g$镁完全反应需$4g$氧气,第一次实验中氧气只有$2g$,氧气不足,镁未完全反应,所以不能生成$8g$氧化镁。
(2)第二次实验时$6g$镁与$4g$氧气恰好完全反应,此后增加氧气质量,由于镁的质量固定为$6g$,根据反应的质量比,镁已完全反应,所以生成氧化镁质量不再增加。
【答案】:$10$;$10$;$10$;$10$
根据镁与氧气反应的化学方程式$2Mg + O_{2}\xlongequal{点燃}2MgO$,可知镁、氧气、氧化镁的质量比为$(2×24):(16×2):(2×(24 + 16)) = 3:2:5$。
当氧气质量为$2g$时,设生成氧化镁质量为$x$,根据质量比$3:5 = 6g:x$,解得$x = 10g$。
当氧气质量为$4g$时,$6g$镁与$4g$氧气恰好完全反应,根据质量比生成氧化镁质量为$10g$。
当氧气质量为$8g$时,$6g$镁只能消耗$4g$氧气,生成氧化镁质量仍为$10g$。
当氧气质量为$12g$时,$6g$镁还是只能消耗$4g$氧气,生成氧化镁质量还是$10g$。
(1)根据化学方程式可知镁、氧气反应时的质量比为$3:2$,$6g$镁完全反应需$4g$氧气,第一次实验中氧气只有$2g$,氧气不足,镁未完全反应,所以不能生成$8g$氧化镁。
(2)第二次实验时$6g$镁与$4g$氧气恰好完全反应,此后增加氧气质量,由于镁的质量固定为$6g$,根据反应的质量比,镁已完全反应,所以生成氧化镁质量不再增加。
【答案】:$10$;$10$;$10$;$10$
查看更多完整答案,请扫码查看


