第87页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
7. (重庆)工业炼钨原理为$WO₃+3H₂\xlongequal{高温}W+3H₂O,$发生还原反应的物质是 (
A. H₂
B. WO₃
C. W
D. H₂O
B
)A. H₂
B. WO₃
C. W
D. H₂O
答案:
B
8. 我国古代将炉甘石、赤铜和木炭粉混合加热到约800℃,可制得外观似金子的合金,其中发生的一个反应的化学方程式为$2Cu₂O+C\xlongequal{800℃}4Cu+X,$下列说法正确的是 (
A. X为CO
B. Cu₂O中铜原子与氧原子的个数比为2:1
C. Cu₂O中Cu的化合价为+2
D. 该反应体现了木炭的氧化性
B
)A. X为CO
B. Cu₂O中铜原子与氧原子的个数比为2:1
C. Cu₂O中Cu的化合价为+2
D. 该反应体现了木炭的氧化性
答案:
B
9. 将6g碳放在盛有10g氧气的密闭容器中燃烧,两者反应均无剩余,所得生成物中 (
A. 只有CO
B. 只有CO₂
C. 既有CO,又有CO₂
D. 不能确定
C
)A. 只有CO
B. 只有CO₂
C. 既有CO,又有CO₂
D. 不能确定
答案:
C
10. 《化学教育》报道了一种“氧化铜还原实验”一体化装置,如图所示。下列说法错误的是 (

A. 用酒精灯加热氧化铜部位,无明显现象,证明二氧化碳不能还原氧化铜
B. 先用酒精灯加热炭粉再加热氧化铜,黑色氧化铜变为红色,证明炭粉还原氧化铜
C. 加热炭粉过程中发生反应$C+CO₂\xlongequal{高温}2CO$
D. 气球可防止有害气体外逸,污染空气
B
)
A. 用酒精灯加热氧化铜部位,无明显现象,证明二氧化碳不能还原氧化铜
B. 先用酒精灯加热炭粉再加热氧化铜,黑色氧化铜变为红色,证明炭粉还原氧化铜
C. 加热炭粉过程中发生反应$C+CO₂\xlongequal{高温}2CO$
D. 气球可防止有害气体外逸,污染空气
答案:
B
11. 用木炭还原氧化铜的实验如图所示。
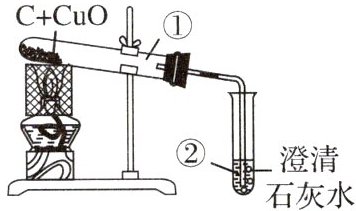
(1) 酒精灯加网罩的目的是
(2) 刚开始预热,试管②中立即产生气泡,但澄清石灰水不变浑浊,原因是
(3) 继续加热,观察到的现象是①中
(4) 某同学观察到具体的现象后,立即停止加热,发现:石灰水倒吸入试管,请你分析产生这一现象的原因:
(5) 某同学观察到具体的现象后,立即停止加热,发现:石灰水倒吸入试管,请你分析产生这一现象的原因:________,该实验结束后的正确做法是先________再________。
(5) 要使80g氧化铜完全还原,需要碳的质量至少是多少?

(1) 酒精灯加网罩的目的是
集中火焰,提高温度
。(2) 刚开始预热,试管②中立即产生气泡,但澄清石灰水不变浑浊,原因是
开始排出的是试管内的空气
。(3) 继续加热,观察到的现象是①中
黑色粉末变成红色
;②中澄清石灰水变浑浊
。这两个现象说明了碳与氧化铜反应生成了铜和二氧化碳
;请你写出该反应的化学方程式:$C + 2CuO \xlongequal{高温} 2Cu + CO_2 \uparrow$
。(4) 某同学观察到具体的现象后,立即停止加热,发现:石灰水倒吸入试管,请你分析产生这一现象的原因:
温度降低,试管①内气压减小
,该实验结束后的正确做法是先将试管②中的导管移出
再熄灭酒精灯
。(5) 某同学观察到具体的现象后,立即停止加热,发现:石灰水倒吸入试管,请你分析产生这一现象的原因:________,该实验结束后的正确做法是先________再________。
(5) 要使80g氧化铜完全还原,需要碳的质量至少是多少?
6g
答案:
(1) 集中火焰,提高温度
(2) 开始排出的是试管内的空气
(3) 黑色粉末变成红色 澄清石灰水变浑浊 铜和二氧化碳 $C + 2CuO \xlongequal{高温} 2Cu + CO_2 \uparrow$
(4) 温度降低,试管①内气压减小 将试管②中的导管移出 熄灭酒精灯(5)
解:设需要碳的质量至少是$x$。
$C + 2CuO\xlongequal{高温}2Cu+CO_{2}\uparrow$
$12$ $160$
$x$ $80g$
$\frac{12}{160}=\frac{x}{80g}$
$x = 6g$
答:需要碳的质量至少是$6g$。
(1) 集中火焰,提高温度
(2) 开始排出的是试管内的空气
(3) 黑色粉末变成红色 澄清石灰水变浑浊 铜和二氧化碳 $C + 2CuO \xlongequal{高温} 2Cu + CO_2 \uparrow$
(4) 温度降低,试管①内气压减小 将试管②中的导管移出 熄灭酒精灯
解:设需要碳的质量至少是$x$。
$C + 2CuO\xlongequal{高温}2Cu+CO_{2}\uparrow$
$12$ $160$
$x$ $80g$
$\frac{12}{160}=\frac{x}{80g}$
$x = 6g$
答:需要碳的质量至少是$6g$。
查看更多完整答案,请扫码查看


