第66页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
对应练
3. 碳酸钠俗称“纯碱”。下列关于碳酸钠的表述不正确的是( )
A. “纯碱”其实不是碱,它属于盐
B. 可以用纯碱代替洗涤剂洗涤餐具表面的油污
C. 可用纯碱除去面团发酵时产生的酸
D. “冬天捞碱”可说明纯碱的溶解度随温度的变化不大
3. 碳酸钠俗称“纯碱”。下列关于碳酸钠的表述不正确的是( )
A. “纯碱”其实不是碱,它属于盐
B. 可以用纯碱代替洗涤剂洗涤餐具表面的油污
C. 可用纯碱除去面团发酵时产生的酸
D. “冬天捞碱”可说明纯碱的溶解度随温度的变化不大
答案:
D
4. 现有一瓶长时间放置的氢氧化钠溶液,试剂瓶口处有白色粉末状固体,某同学感到很好奇,对白色粉末可能的成分进行了猜想:①可能含有氢氧化钠;②可能含有碳酸钠。
(1)该同学得出猜想②的理由是____________________(用化学方程式表示)。
(2)该同学取白色粉末少许,加稀盐酸有气泡产生,证明白色粉末中一定含有__________,其反应的化学方程式是____________________。
(3)小明同学想证明白色粉末中还含有氢氧化钠,于是取少量白色粉末溶于水,滴入酚酞溶液,酚酞变红,因此小明同学认为一定含有氢氧化钠,你认为是否正确并说明理由。
(1)该同学得出猜想②的理由是____________________(用化学方程式表示)。
(2)该同学取白色粉末少许,加稀盐酸有气泡产生,证明白色粉末中一定含有__________,其反应的化学方程式是____________________。
(3)小明同学想证明白色粉末中还含有氢氧化钠,于是取少量白色粉末溶于水,滴入酚酞溶液,酚酞变红,因此小明同学认为一定含有氢氧化钠,你认为是否正确并说明理由。
答案:
(1)$2NaOH+CO_{2}=Na_{2}CO_{3}+H_{2}O$
(2)碳酸钠 $Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow$
(3)不对。碳酸钠溶液显碱性,也能使酚酞试液变红色。
(1)$2NaOH+CO_{2}=Na_{2}CO_{3}+H_{2}O$
(2)碳酸钠 $Na_{2}CO_{3}+2HCl=2NaCl+H_{2}O+CO_{2}\uparrow$
(3)不对。碳酸钠溶液显碱性,也能使酚酞试液变红色。
5. (江西中考)国家标准规定工业纯碱中碳酸钠的质量分数≥98.0%为合格品。为测定某工业纯碱是否为合格品,兴趣小组成员分别进行了下图的实验。(杂质不参与反应,过滤后滤渣损失忽略不计)
(1)溶解时玻璃棒的作用是________。
(2)实验中加入过量CaCl₂溶液的目的是____________________。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是____________________;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果__________(填“偏大”“不变”或“偏小”)。
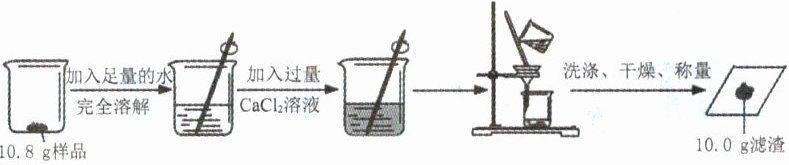
(1)溶解时玻璃棒的作用是________。
(2)实验中加入过量CaCl₂溶液的目的是____________________。
(3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确到0.1%)
(4)实验过程中个别同学出现了以下问题。
①过滤时得到的滤液浑浊,原因可能是____________________;(任写一种)
②过滤所得的滤渣未经洗涤直接干燥,这一操作会导致该样品中碳酸钠的质量分数计算结果__________(填“偏大”“不变”或“偏小”)。

答案:
(1)搅拌
(2)使样品中碳酸钠完全反应
(3)解:设10.8g样品中碳酸钠的质量为x。$CaCl_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow +2NaCl$ 106 100 x 10.0 g $\frac{106}{100}=\frac{x}{10.0g}$ 解得:$x = 10.6g$ 样品中碳酸钠的质量分数为:$\frac{10.6g}{10.8g}\times100\% = 98.1\%>98.0\%$ 答:该工业纯碱为合格品。
(4)①滤纸破损(或液面高于滤纸边缘等) ②偏大
(1)搅拌
(2)使样品中碳酸钠完全反应
(3)解:设10.8g样品中碳酸钠的质量为x。$CaCl_{2}+Na_{2}CO_{3}=CaCO_{3}\downarrow +2NaCl$ 106 100 x 10.0 g $\frac{106}{100}=\frac{x}{10.0g}$ 解得:$x = 10.6g$ 样品中碳酸钠的质量分数为:$\frac{10.6g}{10.8g}\times100\% = 98.1\%>98.0\%$ 答:该工业纯碱为合格品。
(4)①滤纸破损(或液面高于滤纸边缘等) ②偏大
查看更多完整答案,请扫码查看


