第56页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
9. 能用金属与酸反应制取的是 ( )
A. AgCl
B. FeSO₄
C. FeCl₃
D. CuSO₄
A. AgCl
B. FeSO₄
C. FeCl₃
D. CuSO₄
答案:
B
10. 把一根洁净的铁钉放入稀硫酸中,下列叙述正确的是 ( )
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量增加 ④溶液的质量减轻
A. ②③
B. ①②③
C. ①②④
D. ①②
①在铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量增加 ④溶液的质量减轻
A. ②③
B. ①②③
C. ①②④
D. ①②
答案:
D
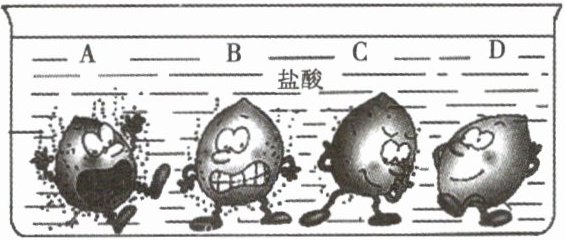
11. 下图是镁、锌、铁、铜四种金属与稀盐酸反应的示意图。
(1)根据图中现象分析,A表示的金属是______。
(2)写出金属C与稀盐酸反应的化学方程式______。
(3)由图中现象可知,影响金属与酸反应快慢的因素有______。
(1)根据图中现象分析,A表示的金属是______。
(2)写出金属C与稀盐酸反应的化学方程式______。
(3)由图中现象可知,影响金属与酸反应快慢的因素有______。

答案:
(1)镁
(2)$Fe + 2HCl=FeCl_{2}+H_{2}\uparrow$
(3)金属的活动性强弱
(1)镁
(2)$Fe + 2HCl=FeCl_{2}+H_{2}\uparrow$
(3)金属的活动性强弱
【例5】 将一枚生锈的铁钉放入稀盐酸溶液中,观察到铁钉表面的红色物质逐渐溶解,之后铁钉表面有气泡出现,检验得知该气体是氢气。根据该实验现象,同学们得出了以下观点:①酸能与某些金属或金属氧化物反应;②反应后,溶液中的溶质是FeCl₃;③铁的金属活动性排在氢之前;④该实验中有置换反应发生。以上说法中,正确的是 ( )
A. ①②③ B. ②③④
C. ①②④ D. ①③④
点拨:铁钉表面生锈的主要成分是氧化铁(Fe₂O₃),盐酸与氧化铁反应生成氯化铁和水,反应前后铁元素的化合价都是+3价,氯化铁溶液呈浅黄色。铁锈反应完后,铁和盐酸反应生成氯化亚铁和氢气,反应方程式为Fe+2HCl = FeCl₂+H₂↑,反应前后铁元素的化合价不同,氯化亚铁溶液呈浅绿色。
答案:______
A. ①②③ B. ②③④
C. ①②④ D. ①③④
点拨:铁钉表面生锈的主要成分是氧化铁(Fe₂O₃),盐酸与氧化铁反应生成氯化铁和水,反应前后铁元素的化合价都是+3价,氯化铁溶液呈浅黄色。铁锈反应完后,铁和盐酸反应生成氯化亚铁和氢气,反应方程式为Fe+2HCl = FeCl₂+H₂↑,反应前后铁元素的化合价不同,氯化亚铁溶液呈浅绿色。
答案:______
答案:
D
12. 将红色的铜丝置于酒精灯火焰上加热,表面变黑。将变黑的铜丝插入盛有稀硫酸的试管中一段时间,则有关说法不正确的是 ( )
A. 铜丝表面变黑,质量增加
B. 变黑的铜丝插入稀硫酸,表面恢复红色
C. 变黑的铜丝插入稀硫酸,铜丝质量不变
D. 变黑的铜丝插入稀硫酸,溶液质量增加
A. 铜丝表面变黑,质量增加
B. 变黑的铜丝插入稀硫酸,表面恢复红色
C. 变黑的铜丝插入稀硫酸,铜丝质量不变
D. 变黑的铜丝插入稀硫酸,溶液质量增加
答案:
C
13. 酸溶液中都含有大量H⁺,因此不同酸表现出一些共同性质。下列关于盐酸性质的描述中,不属于酸的共同性质的是 ( )
A. 能使紫色石蕊试液变为红色
B. 能与氢氧化钠溶液反应生成水
C. 能与硝酸银溶液反应生成氯化银白色沉淀
D. 能与锌反应生成氢气
A. 能使紫色石蕊试液变为红色
B. 能与氢氧化钠溶液反应生成水
C. 能与硝酸银溶液反应生成氯化银白色沉淀
D. 能与锌反应生成氢气
答案:
C
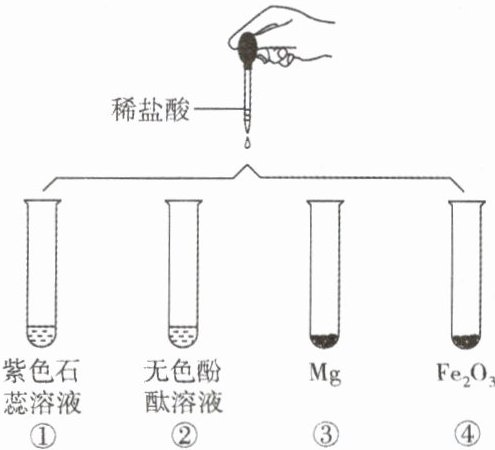
14. 某化学实验小组在研究盐酸的化学性质时,做了下图4个实验。
(1)上述4个实验中没有明显实验现象的是______(填序号)。
(2)实验后,某试管中得到浅黄色溶液,该试管中发生反应的化学方程式为______。
(3)若要制得较纯的H₂,选稀硫酸而不选盐酸的原因是______。
(1)上述4个实验中没有明显实验现象的是______(填序号)。
(2)实验后,某试管中得到浅黄色溶液,该试管中发生反应的化学方程式为______。
(3)若要制得较纯的H₂,选稀硫酸而不选盐酸的原因是______。

答案:
(1)②
(2)$Fe_{2}O_{3}+6HCl=2FeCl_{3}+3H_{2}O$
(3)盐酸具有挥发性,会挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
(1)②
(2)$Fe_{2}O_{3}+6HCl=2FeCl_{3}+3H_{2}O$
(3)盐酸具有挥发性,会挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
查看更多完整答案,请扫码查看


